Лечение алкогольной энцефалопатии головного мозга
Содержание:
- Основные источники развития токсической энцефалопатии
- Симптоматика
- Действующие вещества, относящиеся к коду G93.4
- Общие понятия
- Какое лечение назначают при ГИЭ?
- Суть исследования, проведённого омскими медиками
- Ультразвуковая эхография
- Что называют энцефалопатией у грудничка
- Лечение Сотрясения головного мозга:
- Диагностика
- Лечение в клинике «Энергия здоровья»
- Прогноз
- Лечение гипоксически-ишемической энцефалопатии
- Симптомы энцефалопатии
- Об энцефалопатии
- Аммиак и глутамин
- Патогенез
- Какое лечение назначают при ГИЭ?
Основные источники развития токсической энцефалопатии
Все токсические аномалии формируются в результате попадание в тело вредных веществ, которые поступают в ЦНС. Возбудителем может стать однократное контактирование или употребление, а также длительное перенасыщение токсином. Поэтому медики выделяют две формы болезни: острую и хроническую. К распространенным факторам развития нарушения относят:
- Злоупотребление спиртными напитками и наркотическими препаратами — в ходе длительного приема увеличенных дозировок алкоголя, вследствие чего развивается дефицит витамина группы В. Серьезное влияние на работоспособность центральной нервной системы, оказывает применением наркотиков (героин, амфетамин, кокаин и т.д.).
- Трудовая деятельность на предприятиях, где оказывается вредоносное воздействие на тело сотрудника — источником возникновения токсической энцефалопатии становится долгий контакт с метанолом, свинцом, ртуть, фосфорорганическими соединениями, угарным газом в ходе рабочего дня на заводском предприятии и в шахте.
- Существует вероятность получить аномалию в результате последствий техногенной катастрофы или ошибочного приема пищи с большим количеством химиката.
- Увеличение дозировки лекарственных средств и пренебрежение указаниями лечащего врача вызывают пагубный процесс, который нарушает функционирование ЦНС. На реакцию развития токсической энцефалопатии влияют антидепрессанты, противовоспалительные компоненты нестероидного характера, бензодиазепиновые составляющие и т.д.
- Заболевание печени или почек — так как эти органы несут ответственность за устранение токсичных продуктов обмена веществ при их выраженной недостаточности у пациента начинается накопление ядов экзогенного плана, естественных метаболитов, токсичного аммиака и органической кислоты.
Симптоматика
Симптомы ГИЭ у новорожденного обнаруживаются при помощи тестирования по шкале Апгар. Нередко в околоплодных водах обнаруживаются следы мекония (первые фекалии). Умеренная степень гипоксии может проявляться у новорожденного незначительно. Позже изменения, в том числе неврологический дефицит, обнаруживаются во время осмотра неврологом или планового УЗИ-исследования.

В некоторых случаях младенцу сразу требуется интенсивная терапия. Обычно наблюдаются клинические синдромы:
- Угнетения. Вялость, апатия, гиподинамия, мышечная гипотония, ослабление рефлексов.
- Коматозный. Врожденные рефлексы не возникают на болевые, световые и другие раздражители, атония (отсутствие тонуса мышц), отсутствие двигательной активности.
- Судорожный. Судороги тонико-клонического или тонического типа.
Признаки гипоксически-ишемической энцефалопатии у новорожденных выявляются в ходе инструментальной диагностики и визуального осмотра. Течение заболевания варьируется у разных пациентов. Обычно патология сопровождается оживлением рефлексов, повышенной нервной возбудимостью (спонтанная моторная активность, оживление коленных рефлексов, тремор конечностей). Параллельно выявляются признаки церебральной гипертензии:
- Набухание, выпирание родничка.
- Запрокидывание головы в направлении назад.
- Беспричинный, частый плач.
- Снижение аппетита, отказ от еды.
- Нарушение сна.
- Увеличение диаметра черепа.
- Горизонтальный нистагм.
- Косоглазие сходящегося (зрительная ось отклонена в направлении к носу) типа.
- Мышечная дистония (патологическое сокращение мышц, сопровождающееся непроизвольными движениями).
Для пациентов характерны периоды остановки дыхания во время сна (эпизоды апноэ), апатия, вялость. Пониженная концентрация гемоглобина, характерная для гипоксически-ишемического , усугубляет течение церебральной гипертензии. Длительно текущий патологический процесс провоцирует развитие тканевого отека. Клиническая картина (по данным нейросонографии) включает:
- Кровоизлияния перивентрикулярной (в области желудочковой системы) локализации (40% случаев).
- Расширение желудочков (20% случаев).
- Ишемическое поражение подкорковых (базальных) ядер (10% случаев).
- Изменения диффузного типа в мозговой ткани – ишемическое поражение мозгового вещества в области желудочковой системы, отек паренхимы (структуры, образованные нейронами).
Перивентрикулярное кровоизлияние в сочетании с ишемическим поражением подкорковых ядер выявляется с частотой около 16%. Перивентрикулярное кровоизлияние в сочетании с гидроцефалией и ишемией базальных ядер диагностируется с частотой 14%. Подобные нарушения свидетельствуют о функциональной недостаточности мозга и нарушении мозгового кровотока.
Гипоксическое состояние, спровоцированное отравлением фармацевтическими средствами, нейротропными ядами и другими токсическими веществами, у детей и взрослых сопровождается симптомами, обусловленными специфическим действием ядов и нарушением нервной регуляции на фоне повреждения нервных структур.
Основные признаки: расстройство сознания, протекающее по типу психоза, сбои в работе вегетативной системы, психомоторное возбуждение, судорожный синдром. Первичное нарушение сознания стремительно прогрессирует, трансформируясь в дефицитные формы (сопор, кома). Обычно при этом ослаблена или отсутствует реакция зрачка на свет.
Действующие вещества, относящиеся к коду G93.4
Ниже приведён список действующих веществ, относящихся
к коду G93.4 МКБ-10 (наименования фармакологических групп и
перечень торговых названий, связанных с этим кодом).
- Действующие вещества
-
Алпразолам
Фармакологическая группа: Анксиолитики
-
Ацетилкарнитин
Фармакологическая группа: Прочие метаболики
-
Бетагистин
Фармакологические группы: Ангиопротекторы и корректоры микроциркуляции, Гистаминомиметики
-
Винпоцетин
Фармакологическая группа: Корректоры нарушений мозгового кровообращения
-
Винпоцетин + Пирацетам
Фармакологическая группа: Ноотропы в комбинации с другими препаратами
-
Гамма-аминомасляная кислота
Фармакологическая группа: Ноотропы
-
Гинкго двулопастного листьев экстракт
Фармакологические группы: Ангиопротекторы и корректоры микроциркуляции, Корректоры нарушений мозгового кровообращения
-
Гинкго двулопастного листья
Фармакологические группы: Ангиопротекторы и корректоры микроциркуляции, Корректоры нарушений мозгового кровообращения
-
Глицин
Фармакологические группы: Белки и аминокислоты, Ноотропы, Седативные препараты
-
Гопантеновая кислота
Фармакологическая группа: Ноотропы
-
Дефероксамин
Фармакологическая группа: Детоксицирующие средства, включая антидоты
-
Диметилоксобутилфосфонилдиметилат
Фармакологические группы: Антигипоксанты и антиоксиданты, Антисептики и дезинфицирующие средства, Регуляторы водно-электролитного баланса и КЩС
-
Дипиридамол
Фармакологические группы: Аденозинергические средства, Ангиопротекторы и корректоры микроциркуляции, Антиагреганты, Вазодилататоры
-
Инозин + Никотинамид + Рибофлавин + Янтарная кислота
Фармакологические группы: Анаболики в комбинации с другими препаратами, Витамины и витаминоподобные средства в комбинации с другими препаратами, Прочие метаболики в комбинации с другими препаратами
-
Карнитин
Фармакологические группы: Антигипоксанты и антиоксиданты, Витамины и витаминоподобные средства, Прочие метаболики
-
Левокарнитин
Фармакологические группы: Антигипоксанты и антиоксиданты, Белки и аминокислоты, Витамины и витаминоподобные средства, Прочие метаболики
-
Меклофеноксат
Фармакологическая группа: Ноотропы
-
Метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин
Фармакологическая группа: Ноотропы
-
Мозга крупного рогатого скота гидролизат
Фармакологическая группа: Ноотропы
-
Морфолиний-метил-триазолил-тиоацетат + Пирацетам
Фармакологическая группа: Ноотропы в комбинации с другими препаратами
-
Никотиноил гамма-аминомасляная кислота
Фармакологические группы: Корректоры нарушений мозгового кровообращения, Ноотропы
-
Нитразепам
Фармакологическая группа: Снотворные препараты
-
Омега-3 триглицериды
Фармакологические группы: Антиагреганты, Витамины и витаминоподобные средства, Прочие гиполипидемические средства
-
Пизотифен
Фармакологическая группа: Серотонинергические средства
-
Пирацетам
Фармакологическая группа: Ноотропы
-
Пирацетам + Тиотриазолин
Фармакологическая группа: Ноотропы в комбинации с другими препаратами
-
Пирацетам + Циннаризин
Фармакологическая группа: Ноотропы в комбинации с другими препаратами
-
Пирикарбат
Фармакологическая группа: Ангиопротекторы и корректоры микроциркуляции
-
Пиритинол
Фармакологическая группа: Ноотропы
-
Полипептиды коры головного мозга скота
Фармакологическая группа: Ноотропы
-
Толперизон
Фармакологическая группа: Препараты, влияющие на нервно-мышечную передачу
-
Хлорпротиксен
Фармакологическая группа: Нейролептики
-
Холина альфосцерат
Фармакологическая группа: Ноотропы
-
Циннаризин
Фармакологические группы: Блокаторы кальциевых каналов, Корректоры нарушений мозгового кровообращения
-
Этилметилгидроксипиридина сукцинат
Фармакологическая группа: Антигипоксанты и антиоксиданты
-
Этилметилгидроксипиридина сукцинат +
Фармакологическая группа: Антигипоксанты и антиоксиданты в комбинации с другими препаратами
-
Этиловый эфир N-фенилацетил-L-пропилглицина
Фармакологическая группа: Ноотропы
Общие понятия
Энцефалопатией принято называть органические (необратимые) поражения головного мозга, обусловленные дистрофическими изменениями мозговой ткани. При этом наблюдаются нарушения функций головного мозга – от относительно легких до грубых. В клинической практике выделяют несколько форм энцефалопатий в зависимости от причин, их вызвавших.
Постгипоксическая энцефалопатия (ПЭ) развивается на фоне длительной гипоксии – недостаточной поставки кислорода к нейронам мозга вследствие нарушенного кровоснабжения. Перинатальная ПЭ – нарушения мозговых функций у новорожденных, обусловленных гипоксией во время беременности матери, а также в процессе родов. Причинами ППЭ могут быть также:
- обвитие шеи новорожденного пуповиной;
- недоношенность ребенка;
- высокая масса тела ребенка при рождении.
Какое лечение назначают при ГИЭ?
Лучшим лечением ГИЭ являются профилактика и ранняя терапия внутриутробной гипоксии и асфиксии новорожденного. Но, несмотря на значительные успехи в профилактике осложнений родов, умеренная и тяжелая гипоксически-ишемическая энцефалопатия по-прежнему встречается с частотой 1–2 на 1000 родившихся детей. До недавнего времени медицина могла предложить таким детям лишь поддерживающую терапию дисфункции органов.
С 2010 года стандартом лечения ГИЭ стала индуцированная гипотермия. Этот метод заключается в том, что начиная с 6 часов после рождения температуру тела ребенка в течение 72 часов поддерживают на уровне 33,5 °С. К сожалению, даже после применения индуцированной гипотермии у значительного числа младенцев с ГИЭ сохраняются неврологические расстройства различной степени тяжести.
Сегодня для лечения новорожденных с ГИЭ ученые предлагают новый метод – регенеративную терапию стволовыми клетками пуповинной крови.
Суть исследования, проведённого омскими медиками
Главная цель исследования состояла в том, чтобы понять, насколько последствия ППЦНС поддаются лечению медикаментами. Работу проводили в больнице им. В. Скворцова: было подробно разобрано 200 детских карт с учётом информации:
- о диагнозе ППЦНС в первый год жизни ребёнка;
- о причинах патологии ЦНС;
- о синдромах, выявленных в процессе диагностики;
- о снятии диагноза (если это было);
- о сохранении симптоматики к первым трём годам жизни;
- о лекарственном лечении детей в первые годы жизни;
- о течении неврологических симптомов;
- об исходе болезни к возрасту 17 лет.
Результаты исследования показали, что точный диагноз ППЦНС был поставлен более чем 60% детей ещё на первом году жизни. Факторы, которые способствовали развитию патологии, медики проанализировали и распределили так:
- у 110 детей поражение нервной системы имело гипоксически-ишемическую этиологию;
- у 15 детей заболевание возникло в результате внутриутробного инфицирования;
- у 61 ребёнка ППЦНС развились после травм;
- у 24 детей выявили связь ППЦНС с метаболическим поражением;
- у 82 детей наблюдалось сочетание сразу нескольких факторов.
Что касается снятия диагноза в том или ином возрасте: дети, у которых был только один синдром, выздоравливали намного раньше, если сравнивать с детьми, имевшими два сочетающихся синдрома и более.
Анализ получаемого детьми лекарственного лечения (в первый год жизни) выглядел так: 90 пациентов регулярно принимали лекарства. Из них 35 детей были пролечены одним лекарством, а остальных 55 лечили комплексно, двумя препаратами и более. При этом монотерапия оказалась эффективнее, чем отсутствие лечения медикаментами почти на 11%. У детей, имевших разное количество комбинированных синдромов, высокие результаты показало комбинированное лечение несколькими препаратами.
При оценке статуса ЦНС у пациентов, перенёсших заболевания (по достижении ими 18-летнего возраста) выяснилось, что более 50% молодых людей страдают неврологическими болезнями.
Подводя итоги
Благодаря этому исследованию стали возможны прогнозы в отношении ППЦНС и тяжести его течения. Также выяснилось, что монотерапия одним препаратом является более эффективной нежели отсутствие лечения вообще. Ещё один важный итог исследования — дети с несколькими синдромами поражения ЦНС должны получать комбинированное лечение, которое в таких случаях является оптимальным выходом из ситуации.
Бесплатная консультация по вопросам обучения
Наши консультанты всегда готовы рассказать о всех деталях!
Ультразвуковая эхография
Исследование с помощью ультразвука используется для идентификации внутрипеченочного шунта и для изучения системы печени и желчного пузыря, а также для исследования почек. В некоторых случаях наличия у собак внутрипеченочного шунта печень имеет малые размеры, вены печени очень малы или совсем неразличимы, а почечная лоханка увеличена. При правильном проведении ультразвуковая диагностика может дать решающие данные для правильного диагностирования гепатоэнцефалопатии.Ядерная сцинтиграфия печени представляет собой неинвазивный метод, пригодный для диагностики, однако его редко используют в повседневной практике.
Что называют энцефалопатией у грудничка
С медицинской точки зрения ПЭП – не диагноз. Понятие энцефалопатия обозначает дисфункции работы мозга, которые выражаются в различных синдромах, состояниях, задержках физического, психомоторного развития. Основная причина – гибель клеток головного мозга, нейронов. Эти синдромы отличает схожесть симптомов, причин, по которым они возникают.
Энцефалопатию вызывают токсические, травматические, метаболические факторы. Ведущую роль играет гипоксия – недостаток кислородного питания при внутриутробном развитии или нарушения дыхательных функций у новорожденного. Факторы часто накладываются, усиливают действие друг друга. Нередко ПЭП остается неуточненной – выяснить причины не удается.
Лечение Сотрясения головного мозга:
При сотрясении необходимо в обязательном порядке обратиться к врачу, поскольку поначалу симптомы сотрясения и более тяжелых травм мозга (например, ушиб мозга или внутричерепное кровоизлияние) могут быть идентичны. Только врач может определить, какая конкретно травма была получена. Не исключено, что может потребоваться рентгенологическое обследование (снимок костей черепа) с целью исключения перелома костей черепа.
Медицинское общество штата Колорадо прописала инструкции по помощи спортсменам при разных степенях повреждения:
1 Степень.
Отстранить пострадавшего от соревнований. Немедленно обследовать его и повторить обследование каждые 5 мин в спокойном состояния при напряжении с целью определения признаков развитие амнезии и симптомов после сотрясения мозга. Разрешить вновь участвовать в соревнованиях, если в течение 20 мин не наблюдается признаков амнезий или других симптомов заболевания.
2 Степень.
Отстранить пострадавшего от соревнований. Проводить регулярный осмотр с целью выявления признаков развивающейся внутричерепной патологии. Провести обследование на следующий день. Разрешить вновь участвовать в занятиях спортом не ранее чем через неделю при отсутствии симптомов заболевания.
3 Степень.
Перевезти пациента на санитарной машине с игрового поля в ближайшую больницу (при иммобилизации шейного отдела позвоночника, если имеются к тому показания).
Провести тщательную срочную оценку неврологического статуса бального. При обнаружении признаков патологии поместить в больницу. Если результаты оценки положительные, проинструктировать членов семьи в отношении организации ночного дежурства. Разрешить вновь принимать участие в занятиях спортом не ранее чем через 2 недель при отсутствии симптомов болезни.
Больные с сотрясением мозга должны соблюдать постельный режим, как минимум несколько дней. При этом нельзя читать, слушать музыку и даже смотреть телевизор. Необходимо выполнять все указания врача, пить болеутоляющие и успокаивающие лекарства и препараты, улучшающие работу мозга. При сотрясении общее состояние пострадавших обычно быстро нормализуется в течение первой, реже — второй недели после травмы.
Необходимо помнить, что у человека, перенесшего даже легкое сотрясение мозга, может развиться посттравматический невроз или другие, более серьезные осложнения, например, эпилепсия. Поэтому через некоторое время после выздоровления обязательно следует пройти электроэнцефалографию и посетить невропатолога.
Лечение более серьезных черепно-мозговых травм зависит от их тяжести. В экстренных случаях может потребоваться помощь нейрохирургов.
После выписки из больницы.
Если после выписки из больницы самочувствие пациента остается неважным, обычно обнаруживается сохраняющееся повышение внутричерепного давления и/или повреждение суставов и связок, соединяющих череп с шейным отделом позвоночника. Это нетрудно установить с помощью магнитно-резонансной томографии головного мозга и рентгеновского исследования шейных позвонков. Здесь потребуется небольшая коррекция курса лечения (специальная гимнастика и лекарственные препараты), которая в течение 1-2 недель, обычно приводит к улучшению. Всего плановый курс приема лекарств после сотрясения мозга составляет не менее двух месяцев.
Диагностика
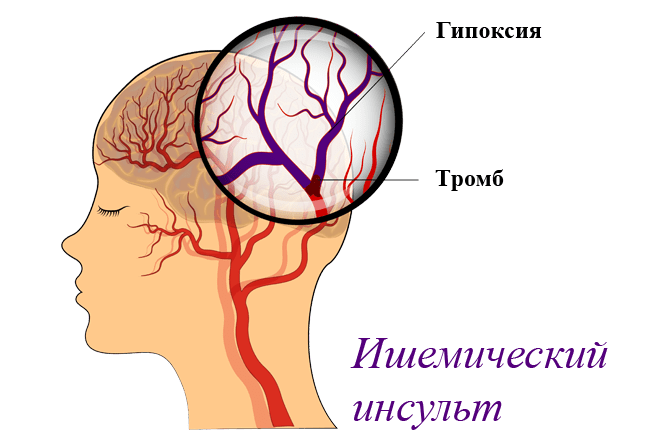
Перинатальный синдром ишемии на фоне гипоксии мозга начинают диагностировать, делая визуальный осмотр ребенка. Так же и со взрослыми. Несмотря на все достижения медицины, уникальный тест, позволяющий точно выявить ГИЭ, до сих пор не придуман. Все лабораторные методики направлены на выявление того, насколько сильно поврежден мозг и текущее состояние всего организма.
Какими будут исследования, зависит от симптомов, и как они развивались. Для расшифровки анализов есть специальные биомаркеры, которые дают полную картину о степени ГИЭ. Для исследования нужна кровь больного.
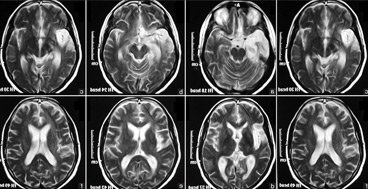
Нейровизуализацию проводят с помощью:
- нейросонографа и/или МРТ, томографа, показывающего внутренние повреждения мозга и изменения в нем;
- доплерографа, фиксирующего работу мозгового кровотока;
- электронейромиографа для определения чувствительности волокон периферии нервной системы.
Дополнительного могут использовать:
- электроэнцефалограф для выявления задержки развития на ранней стадии и есть ли эпилепсия;
- видеомониторинг для изучения двигательной активности малышей.
При необходимости пострадавшего осматривает окулист, чтобы определить состояние зрительных нервов и глазного дна, а также на наличие болезней генетического типа в этой области.
Лечение в клинике «Энергия здоровья»
Врачи клиники «Энергия здоровья» всегда готовы принять пациента любого возраста. Мы проведем тщательное обследование, выявим возможные причины энцефалопатии и примем все меры по ее устранению:
- назначим наиболее подходящую терапию, распишем курс лечения и частоту его повторения;
- проведем все необходимые манипуляции (постановка капельницы, внутривенные и внутримышечные инъекции) в комфортабельных условиях дневного стационара и манипуляционного кабинета;
- дополним терапию современными физиотерапевтическими процедурами;
- проведем курс массажа и назначим ЛФК для максимальной эффективности.
Наши неврологи будут контролировать состояние пациента и корректировать лечение при необходимости. Лечение энцефалопатии – это длительный и сложный процесс, но мы готовы за него взяться.
Прогноз
Восстановление ребенка возможно, при этом наступает полноценное выздоровление. Однако нельзя исключать, что малыш останется инвалидом, если гипоксия имела тяжелое течение. Также возможно развитие незначительной мозговой дисфункции с малосимптомным течением патологии.
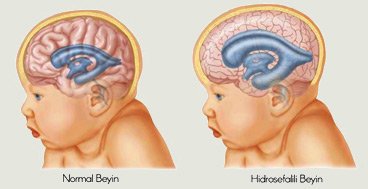
Последствиями гипоксически-ишемической энцефалопатии является эпилепсия, ДЦП, гидроцефалия, олигофрения. Последнее нарушение отличается стойкостью во времени, вылечить олигофрению невозможно.
Если ребенок незначительно отстает в развитии на протяжении первого года жизни, но при этом получает адекватное лечение, скорее всего, он догонит своих сверстников в недалеком будущем, и ничем не будет отличаться от здоровых детей.
Автор статьи:
Алексеева Мария Юрьевна | Терапевт Образование: С 2010 по 2020 гг. практикующий врач терапевтического стационара центральной медико-санитарной части №21, город электросталь. С 2020 года работает в диагностическом центре №3. Наши авторы
Лечение гипоксически-ишемической энцефалопатии
Включает в себя прием медикаментов, физические методы воздействия (физиотерапевтические процедуры, массаж и лечебную физкультуру), педагогические занятия, иглорефлексотерапию.
Уход
Грамотный уход за детьми, больными ГИЭ, состоит в соблюдении следующих правил:
температура воздуха в помещении не должна превышать 25°С;
ребенок должен лежать в удобной позе, ни в коем случае нельзя использовать тугое пеленание;
свет в комнате или палате должен быть мягкий, приглушенный;
очень важно соблюдать тишину;
при постоянном заборе крови желательно установить катетер;
для скорейшей реабилитации нужно общаться с малышом, кормить его, обеспечить контакт «кожа к коже»;
в случае нарушения дыхания необходимо обеспечить вспомогательную вентиляцию;
следует следить за питанием в соответствии с суточной потребностью ребенка.
Хирургическая терапия
Хирургическое лечение гипоксически-ишемической энцефалопатии заключается в проведении манипуляций для улучшения мозгового кровообращения.
Антиконвульсанты
Это препараты, которые используются для купирования судорог.
| Название | Фенобарбитал (Люминал). |
| Доза для детей |
|
| Противопоказания |
|
| Беременность | Опасен. |
| Название | Лоразепам (Ативан). |
| Доза для детей |
|
| Противопоказания |
|
| Беременность | Опасен. |
| Название | Фенитон (Дилантин). |
| Доза для детей |
|
| Противопоказания | Зафиксированная гиперчувствительность, синусовая брадикардия, вторая и третья степень атриовентрикулярной блокады, синоатриальная блокада или синдром Адам-Стокса, внутримышечное введение строго противопоказано. |
| Беременность | Опасен. |
Сердечно-сосудистые средства
Лекарства из этой группы увеличивают системное сосудистое сопротивление и сократимость миокарда, таким образом, повышая сердечный выброс.
В основном эти эффекты полезны, но при повышении дозы системные побочные эффекты могут быть непредсказуемы.
| Название | Допамин (Интропин). |
| Доза для детей |
|
| Противопоказания |
|
| Беременность | Безопасность использования препарата во время беременности не была установлена. |
Название
Добутамин (Добутрекс).
Доза для детей
2-25 мкг/кг в минуту путем длительного внутривенного введения, начиная с более низких доз.
Увеличивают их с учетом показателей системного АД, соответствующего возрасту младенца и сроку беременности.
Противопоказания
Зафиксированная гиперчувствительность, фибрилляция предсердий и идеопатический гипертрофический субаортальный стеноз.
Беременность
По большей части не представляет опасности, но должен назначаться осторожно — только в том случае, когда необходимость его применения многократно превышает риск возможных осложнений.
Симптомы энцефалопатии
Клинические проявления различаются. На ранних стадиях преобладают неспецифические симптомы: жалобы на повышенную утомляемость, бессонницу, ухудшение памяти, вялость, трудности с акцентированием внимания, раздражительность.
Общее состояние осложняется головной болью, головокружением и шумом в ушах.
Прогрессирование заболевания увеличивает объем неврологической симптоматики. Нарушаются мышечный тонус и координация движений, усиливаются сухожильные рефлексы. В более тяжелых случаях человек страдает от эпилептических припадков, пирамидного синдрома, паркинсонизма.
Для более поздних стадий энцефалопатии головного мозга характерны галлюцинации и деменция (слабоумие).
Об энцефалопатии
Энцефалопатия головного мозга – это даже не заболевание, а синдром, обуславливающийся негативными факторами, которые влияют на мозг. При прогрессировании энцефалопатии образуются нарушения в составе крови и ряд других заболеваний, что приводит к гибели нейронов. В некоторых ситуациях отмечается появление маленьких участков кровоизлияния, возникает инсульт. В итоге пациент с синдромом утрачивает важные функции, за которые отвечает головной мозг.
Недуг подразделяется на врожденный и приобретенный. Разберем каждый подробнее.
Перинатальный тип
Врожденная энцефалопатия появляется из-за нарушения метаболизма между матерью и малышом. Существует прямая связь с образом жизни будущей мамы. Например, употребляя спиртные напитки или обладая пристрастием к сигаретам, человек сам провоцирует генетические мутации, что с легкостью станет поводом для энцефалопатии головного мозга.
Еще существуют причины, не зависящие от матери: обвитие пуповиной, инфекционные заболевания, которые перенесла мама при беременности, или родовые травмы. Заботясь о еще не рожденном малыше и своевременно консультируясь у медиков, которым доверяете, вы делаете вклад в здоровье и счастье своей семьи.
Необходимы не только анализы и шаблонные скрининги, но и подготовка к родам у специфических специалистов — как физическая, так и психологическая.

Обретенная энцефалопатия делится на несколько подвидов:
- дисциркуляторная,
- посттравматическая,
- лучевая,
- многоочаговая,
- токсическая
- и развивающаяся сосудистая.
Первый вид развивается из-за аномалий сосудов или невоспалительных повреждений коры головного мозга, что приводит к глобальному нарушению кровообращения.
Причина возникновения посттравматической – травмы головы. Наиболее распространенная – черепно-мозговая травма. Встречается у спортсменов, в частности у боксеров, самбистов.
Поводом к лучевой энцефалопатии служит радиоактивное излучение. Это вызывается, к примеру, частыми рентгенографическими снимками или нахождением в зоне повышенной радиации.
Метаболическая энцефалопатия возникает из-за скарификации обменных процессов. Появление этого вида не зависит от расовой или половой принадлежностей. Формируется у детей и взрослых.
Развивающаяся многоочаговая энцефалопатия возникает, если организм находится во власти таких опасных состояний, как СПИД, ВИЧ, онкология и так далее.
Токсико-экзогенная энцефалопатия вызывается токсичным влиянием. Также определенные медикаменты угнетающе влияют на работу мозга.
Прогрессирующая сосудистая энцефалопатия – нарушение функционирования артерий головного мозга или их дисфункция вовсе. Причиной нередко служит наличие гипертензии.

Аммиак и глутамин
В патогенезе гепатоэнцефалопатии аммиак — наиболее изученный фактор. Аммиак выделяется при расщеплении белков, аминокислот, пуринов и пиримидинов. Около половины аммиака, поступающего из кишечника, синтезируется бактериями, а оставшаяся часть образуется из белков пищи и глутамина. В норме в печени аммиак превращается в мочевину и глутамин. Нарушение цикла мочевины ведут к развитию энцефолопатии. Уменьшение количества мочевины в крови может служить показателем развивающейся гепатоэнцефолопатии. Уровень аммиака повышен в крови у 90% пациентов. Содержание его в головном мозге может быть тоже увеличено. При пероральном получении солей аммония у некоторых больных может развиться гепатоэнцефолопатия.
Сама по себе гипераммониемия связана со снижением проведения возбуждения в ЦНС. Интоксикация аммиаком ведет к развитию гиперкинетического предсудорожного состояния. При гепатоэнцефолопатии основные механизмы действия аммиака заключаются в прямом воздействии на мембраны нейронов или на постсинаптическое торможение и в опосредованном нарушении функций нейронов в результате влияния на глутаматергическую систему.
Патогенез
Метаболическая теория развития гепатоэнцефолопатии основывается на обратимости ее основных расстройств при обширных церебральных нарушениях. Не существует единственного метаболического нарушения, вызывающего гепатоэнцефолопатию.
В основе ее лежат снижение печеночного клиренса образующихся в кишечнике веществ как вследствие печеночно-клеточной недостаточности, так и за счет значительного шунтирования, а также нарушение метаболизма аминокислот. Оба эти механизма ведут к нарушениям в церебральных нейротрансмиттерных системах.
В патогенезе гепатоэнцефолопатии участвуют несколько нейротоксинов, особенно аммиак, и несколько нейромедиаторных систем, взаимодействующих между собой.
У каждого больного, находящегося в состоянии комы или прикомы, кровь может попадать из воротной вены в системные вены, минуя печень и не проходя детоксикацию.
У больных с нарушением функции гепатоцитов, например при остром гепатите, кровь шунтируется внутри печени. Поврежденные гепатоциты не в состоянии в полной мере проводить детоксикацию крови портальной системы, поэтому кровь поступает в печеночные вены с токсинами. При циррозе кровь из воротной вены минует печень по большим естественным коллатералям, поступает в системные вены. Кроме того, в пораженной циррозом печени вокруг долек образуются портопеченочные венозные анастомозы, которые функционируют как внутрипеченочные шунты.
Какое лечение назначают при ГИЭ?
Лучшим лечением ГИЭ являются профилактика и ранняя терапия внутриутробной гипоксии и асфиксии новорожденного. Но, несмотря на значительные успехи в профилактике осложнений родов, умеренная и тяжелая гипоксически-ишемическая энцефалопатия по-прежнему встречается с частотой 1–2 на 1000 родившихся детей. До недавнего времени медицина могла предложить таким детям лишь поддерживающую терапию дисфункции органов.
С 2010 года стандартом лечения ГИЭ стала индуцированная гипотермия. Этот метод заключается в том, что начиная с 6 часов после рождения температуру тела ребенка в течение 72 часов поддерживают на уровне 33,5 °С. К сожалению, даже после применения индуцированной гипотермии у значительного числа младенцев с ГИЭ сохраняются неврологические расстройства различной степени тяжести.
Сегодня для лечения новорожденных с ГИЭ ученые предлагают новый метод – регенеративную терапию стволовыми клетками пуповинной крови.