Микроскопия
Содержание:
- Микроскопия мазка на флору
- Патогенность для животных
- Культуральное исследование
- § 3. Устройство микроскопа и техника микроскопирования
- Оптическая микроскопия
- История
- Иммунологическое и биологическое исследования
- Морфологические и тинкториальныe свойства
- Процедура взятия мазка на флору
- Разрешающая способность
- Антигенная структура и отношение к бактериофагу
- Электронная микроскопия
Микроскопия мазка на флору
Лабораторная микроскопия полученного материала осуществляется в течение дня либо за 15 минут в ускоренном режиме. В лаборатории мазки окрашиваются специальными красителями и микроскопируются под различными увеличениями. В гинекологии при исследовании мазка на флору одно стекло окрашивается синим митиленовым, другое — по Граму, то есть кристаллическим фиолетовым или обесцвечиваются в спирте. Бактерии, окрашенные по Граму, могут принимать разную окраску в зависимости от положительного или отрицательного характера микробов.
При микроскопии мазков из заднего свода влагалища определяют степень чистоты содержимого. Мазки, полученные из шейки матки и уретры, исследуются на предмет флоры и содержание гонококков.
Степени нормы определяются следующим содержимым: должны присутствовать клетки плоского эпителия из шейки матки и влагалища. Отсутствие клеток говорит о недостатке гормонов эстрогена, избыточном количестве андрогенов или же об атрофическом состоянии эпителиального слоя. Повышенное количество лейкоцитов говорит о воспалительном процессе во влагалище — кольпите. Количество лейкоцитов определяет степень тяжести заболевания.
Наличие некоторого количества золотистого стафилококка говорит о норме флоры. Увеличенное количество говорит о воспалении во влагалище или слизистой оболочке матки.
Что касается содержания микроорганизмов, то в норме допустимо содержание только лактобацилл. Присутствие стрептококков, пневмококков, стафилококков, энтерококков, гонококков, грибков, анаэробов говорит о наличии инфекции в области уретры.
При обнаружении отклонений от норм проводится ряд дополнительных диагностических лабораторных исследований, например, ПЦР.
Патогенность для животных
Патогенность микробов обычно определяют в опытах на белых мышах, морских свинках и кроликах. Животных заражают подкожно, внутрикожно, внутримышечно, внутривенно, интраперитонеально, перорально, интраназально или интрацеребрально (см. Биологическая проба).
При изучении патогенных микроорганизмов иногда требуется определить, образуют ли они экзотоксины. С этой целью на чувствительных животных испытывается фильтрат бактериальной культуры, выращенной в течение определенного срока на соответствующей жидкой среде. Экзотоксины высокотоксигенных бактерий (дифтерийной палочки, столбнячной бациллы, ботулинической бациллы и др.) вызывают заболевание животных с характерной клин, картиной и последующую их гибель с типичными патол ого анатомическими изменениями. Для обнаружения некоторых микробных экзотоксинов применяют культуры чувствительных к ним тканей, а также куриные эмбрионы. Нейтрализация экзотоксинов специфическими антитоксинами играет существенную роль при И. м.
Библиография: Красильников Н. А. Определитель бактерий и актиномицетов, М.—Л., 1949, библиогр.; Руководство по микробиологической диагностике инфекционных болезней, под ред. К. И. Матвеева, М., 1973; Тим а ков В. Д. и Гольдфарб Д. М. Основы экспериментальной медицинской бактериологии, М., 1958, библиогр.; Bergey’s manual of determinative bacteriology, ed. by R. E. Buchanan a. N. E. Gibbons, Baltimore, 1975, bibliogr.; Cowan S. T. a. Steel K. J. Manual for the identification of medical bacteria, Cambridge, 1974; Identification methods for microbiology, ed. by В. M. Gibbs a. F. A. Skinner, v. 1—2, L.— N. Y., 1966—1968; International code of nomenclature of bacteria, ed. by S. P. Lapage a. o., Washington, 1975; M e у n e 1 1 G. G. a. M e y n e 1 1 E. Theory and practice in experimental bacteriology, Cambridge, 1970, bibliogr.; Nomura M. Colicins and related bacteriocins, Ann. Rev. Microbiol., v. 21, p. 257, 1967, bibliogr.; W i 1-s o n G. S. a. M i 1 e s A. A. Topley and Wilson’s principles of bacteriology and immunity, v. 1—2, L., 1964.
Культуральное исследование
Проводят посев материала на стандартную среду Сабуро, часто с добавками антибиотиков. В диагностике дерматофитных инфекций принято добавлять в среду Сабуро циклогексимид, подавляющий рост грибов-контаминантов, попадающих из воздуха. Существуют готовые коммерческие среды с добавками антибиотиков и циклогексимида. Следует помнить, что многие плесневые грибы-недерматофиты и некоторые виды Candida не растут на среде с циклогексимидом, поэтому рекомендуется делать посев на среду Сабуро с циклогексимидом и на среду без него. Идентификацию видов обычно проводят при микроскопическом исследовании выросшей культуры или путем пересева на селективные среды (рис. 2-15).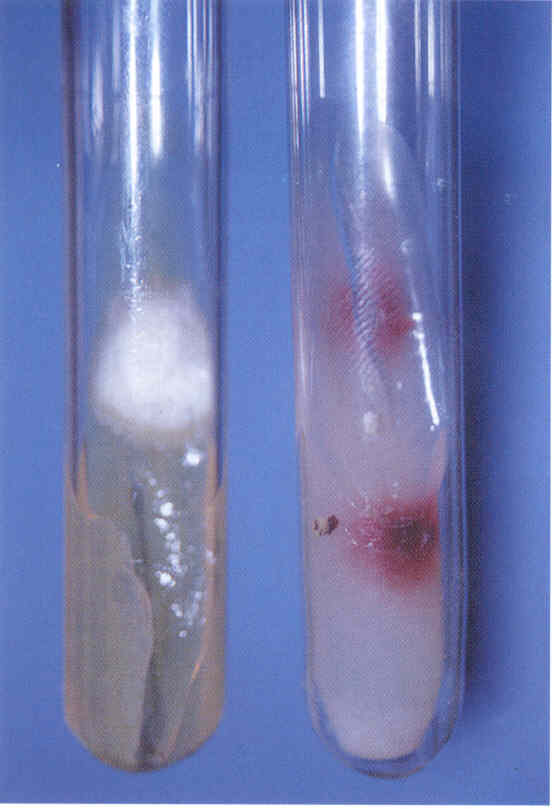
Рис. 2. Культура гриба Т. rubrum, выделенного из пораженных ногтей. Получена на среде Сабуро (слева) и кукурузном агаре (справа)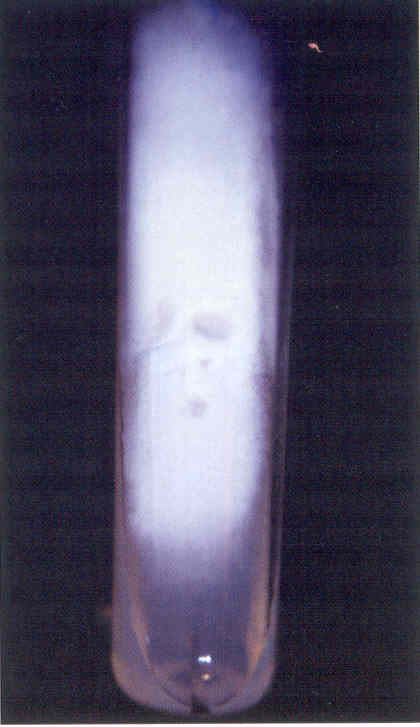
Рис. 3. Культура гриба Т. mentagrophytes var. interdigitale, выделенного из пораженных ногтей. Получена на среде Сабуро.
Рис. 4. Культура гриба Candida albicans. Получена на среде Сабуро. 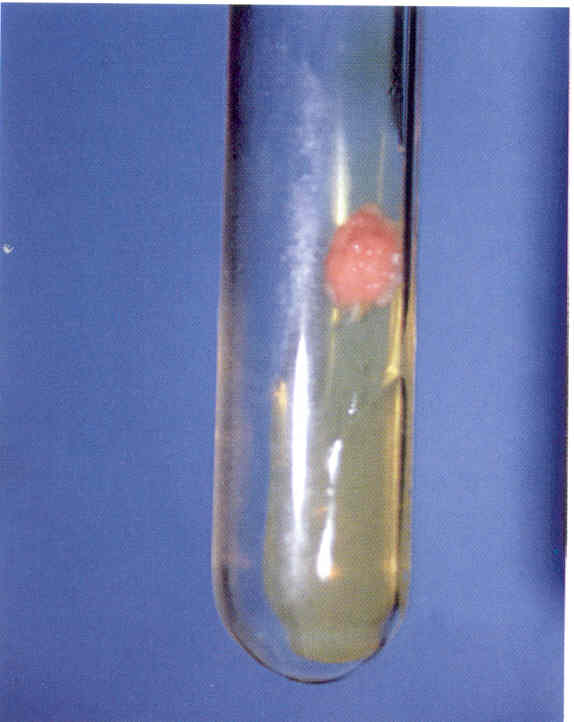
Рис. 5. Культура гриба Torulopsis glabrata, выделенного из пораженных ногтей. Получена на среде Сабуро.
Рис. 6. Культура гриба Ulocladium sp., выделенного из пораженных ногтей.
Рис. 7. Микроморфология Acremonium sp., выделенного из пораженных ногтей. 
Рис. 8. Микроморфология Fusarium sp., вьщеленного из пораженных ногтей.
Рис. 9. Микроморфология Scopulariopsis sp., выделенного из пораженных ногтей.
Рис. 10. Микроморфология Candida albicans, выделенного из пораженных ногтей.
Рис. 11. Микроморфология Altemaria sp., выделенного из пораженных ногтей.
Рис. 12. Микроморфология Aspergillus sp., выделенного из пораженных ногтей.
Рис. 13. Микроморфология Ulocladium sp , выделенного из пораженных ногтей.
Рис. 14. Микроморфология Chaetomium sp., выделенного из пораженных ногтей. 
Рис 15. Панель питательных фед для идентификации дерматофитов (слева — культура Т rubrum, справа — Т mentagrophytes var. mterdigitale). Слева направо: среда Сабуро, среда Бакстера, среда Христенсена, кукурузный агар
Следует учесть, что некоторые плесневые грибы, в том числе дерматофиты, в культуре вырастают медленно, за 2-3 нед.
Даже при соблюдении всех правил сбора материала, при хорошем оборудовании лаборатории и высокой квалификации ее персонала число положительных результатов культурального исследования очень невелико.
По данным зарубежной литературы, процент положительных исследований не превышает 50.
Процент положительных результатов в лучших отечественных лабораториях едва достигает 30.
Таким образом, в 2 из каждых 3 случаев онихомикоза его этиологию установить не удается.
§ 3. Устройство микроскопа и техника микроскопирования
Для исследования дрожжей, бактерий и плесневых грибов применяют микроскопы, предназначенные для рассмотрения прозрачных препаратов в проходящем свете (рис. 8).
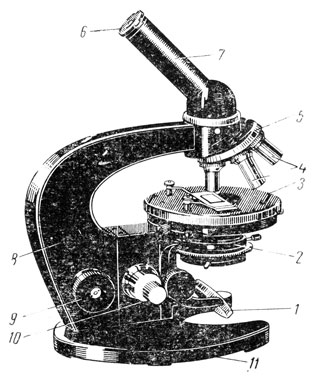 Рис. 8. Микроскоп МБИ-1: 1 — зеркало, 2 — конденсор, 3 — предметный столик, 4 — объективы, 5 — револьвер, 6 — окуляр, 7 — тубус, 8 — тубусодержатель, 9 — макрометрический винт, 10 — микрометрический винт, 11 — ножка
Рис. 8. Микроскоп МБИ-1: 1 — зеркало, 2 — конденсор, 3 — предметный столик, 4 — объективы, 5 — револьвер, 6 — окуляр, 7 — тубус, 8 — тубусодержатель, 9 — макрометрический винт, 10 — микрометрический винт, 11 — ножка
Оптическая часть микроскопа. Основной частью оптической системы микроскопа является объектив, увеличивающий изображение предмета. Он состоит из ряда линз, склеенных канадским бальзамом и заключенных в металлическую трубку; на трубке имеется резьба, при помощи которой объектив ввинчивается в специальное гнездо револьвера.
Изображение, даваемое объективом, рассматривают с помощью окуляра, находящегося в верхней части тубуса микроскопа. Биологические микроскопы снабжаются тремя сменными окулярами. На верхней оправе линзы окуляра указано его увеличение. Обычно окуляры дают увеличение в 7, 10 и 15 раз. Общее увеличение объекта микроскопом равно произведению увеличения окуляра на увеличение объектива = 900 раз.
Осветительное устройство располагается под столиком микроскопа и состоит из конденсора с ирис-диафрагмой и зеркала.
Механическая часть микроскопа. Эта часть состоит из штатива, тубусодержателя с револьвером, винтов для передвижения тубуса (макрометрического и микрометрического), осветительного аппарата и предметного столика микроскопа. Основными частями штатива являются нижняя подставка (ножка), придающая микроскопу устойчивость, и тубусодержатель микроскопа.
Техника микроскопирования. Прежде чем начать микроскопирование, необходимо установить правильное освещение. Для этого с микроскопа снимают окуляр и, глядя прямо в объектив, устанавливают зеркало так, чтобы источник света (лампа или окно) были видны посредине объектива. После предварительной установки света на предметный столик микроскопа кладут готовый препарат и закрепляют его зажимами. При помощи макрометрического винта опускают тубус почти до соприкосновения с покровным стеклом. Затем, глядя в окуляр, постепенно поднимают тубус до появления изображения. Для наведения резкости пользуются микрометрическим винтом.
При микроскопиравании следует держать оба глаза открытыми. Смотрят в микроскоп левым глазом.
Техника приготовления препарата для микроскопирования
Каплю исследуемой жидкости наносят на чистое предметное стекло и осторожно накрывают покровным стеклом. Если препарат готовят с плотной питательной среды, то на предметное стекло наносят капельку чистой водопроводной воды, в нее помещают исследуемую культуру и препарат накрывают покровным стеклом
Под последним не должно оставаться пузырьков воздуха, так как они мешают микроскопированию. Избыток жидкости, выступающий из-за покровного стекла, убирают фильтровальной бумагой, заранее нарезанной небольшими узкими полосками. Готовый препарат помещают на предметный столик и исследуют.
Техника посевов на питательные среды и состав сред описаны в разделе «Микробиологический контроль».
маникюр краснодар
Оптическая микроскопия
Бинокулярный стереомикроскоп. Модель 1970-х годов
Человеческий глаз представляет собой естественную оптическую систему, характеризующуюся определённым разрешением, то есть наименьшим расстоянием между элементами наблюдаемого объекта (воспринимаемыми как точки или линии), при котором они ещё могут быть отличены один от другого. Для нормального глаза при удалении от объекта на т. н. расстояние наилучшего видения (D = 250 мм), среднестатистическое нормальное разрешения составляет 0,176 мм. Размеры микроорганизмов, большинства растительных и животных клеток, мелких кристаллов, деталей микроструктуры металлов и сплавов и т. п. значительно меньше этой величины. Для наблюдения и изучения подобных объектов и предназначены оптические микроскопы различных типов.
В оптической микроскопии в настоящее время сделан прорыв, в результате которого преодолен фундаментальный рэлеевский критерий, заключающийся в том, что минимальный размер различимого объекта несколько меньше длины волны используемого света и принципиально ограничен дифракцией излучения. Это был предел возможному в оптической микроскопии. До недавнего времени нельзя было преодолеть барьер, позволяющий различать структуры с расстоянием между элементами до 0,20 мкм.
Тем не менее выдающаяся последняя разработка оптической системы наноскопа с оптическим разрешением 10 нм расширила диапазон оптической микроскопии — наноскопии до десятков нанометров, что по сравнению с 0,20 мкм в 20 раз сократило расстояние между различаемыми элементами. (Например, размер белковых молекул, из которых состоит наш организм, колеблется от 3 до 10 нм).
Немецкие ученые Штефан Хелль (англ. Stefan Hell) и Мариано Босси (англ. Mariano Bossi) из Института биофизической химии в 2006 году разработали наноскоп, позволяющий наблюдать объекты размером около 15 нм.
Российские учёные из Томского государственного политехнического университета усовершенствовали наноскоп, использовав в нём не микролинзы, как в классической конфигурации, а специальные дифракционные решетки с золотыми пластинками. При получении изображения с такого прибора срабатывают одновременно эффект аномальной амплитудной аподизации, резонанс Фабри — Перо и резонанс Фано. Вместе они и помогают увеличить разрешение, по сравнению с обычной дифракционной решеткой, до 0,3 λ.
История
Первоначально микроскопы были только оптическими приборами, использующими лучи видимого света, так как и глаз работает в оптическом диапазоне длин волн. Соответственно, оптические микроскопы не могли иметь разрешения менее полупериода волны опорного излучения (для видимого диапазона длина волн 0,4—0,7 мкм, или 400—700 нм) c возможным максимальным увеличением в 2000 раз.
Идея просвечивающего электронного микроскопа состояла в замене опорного электромагнитного излучения на электронный пучок. Известно, что для увеличения разрешения микроскопов, использующих электромагнитное излучение, необходимо уменьшение длины волны электромагнитного излучения до ультрафиолетового диапазон вплоть до рентгеновского (длина волны сопоставима с межатомными расстояниями в веществе) и основная трудность состоит в фокусировке ультрафиолетовых и, тем более, рентгеновских лучей.
Особенность взаимодействия рентгеновских лучей с веществом отличает рентгеновские оптические системы от оптических систем для световых и электронных лучей. (Малое отклонение показателя преломления рентгеновских лучей от единицы (меньше чем на 10−4) практически не позволяет использовать для их фокусировки линзы и призмы. Электрические и магнитные линзы для этой цели также неприменимы, так как рентгеновские лучи инертны к электрическому и магнитному полям. Поэтому в микроскопии рентгеновской для фокусировки рентгеновских лучей используют явление их полного внешнего отражения изогнутыми зеркальными плоскостями или отражение от кристаллографических изогнутых плоскостей). На этом принципе построены отражательные рентгеновские микроскопы.
Иммунологическое и биологическое исследования
Иммунологические методы исследования используют для выявления специфической перестройки организма и серологической диагностики грибковых заболеваний. Для обнаружения специфических антител в сыворотке пробы проводят следующие серологические реакции: агглютинации, преципитации, связывания комплемента, иммунофлюоресценции с соответствующими антигенами.
Аллергическое состояние организма больного выявляют с помощью аллергических кожных проб. Аллергены наносят на скарифицированную кожу по Пирке или втиранием в кожу по Моро, внутрикожно по Манту, а также уколом в кожу. С помощью этих проб выявляют аллергические реакции как немедленного, так и замедленного типа, что позволяет оценить состояние гуморального и клеточного иммунитета.
Для выявления специфической сенсибилизации лимфоцитов используют реакции дегрануляции базофилов, агломерации и альтерации, тест бластной трансформации, подавления миграции макрофагов и т. п.
Сопоставление результатов серологических и аллергических реакций оказывается полезным как для диагностики, так и для прогноза течения микозов.Биологический метод. Используется для лабораторной диагностики глубоких и особо опасных микозов. Основан на заражении животных патологическим материалом от больного или культурой исследуемого гриба. Осуществляется в специальных лабораториях.
Морфологические и тинкториальныe свойства
Изучение морфол, и тинкториальных признаков микроба является обычно лишь первоначальной стадией его идентификации. Морфология микроорганизмов изучается путем микроскопии фиксированных и окрашенных препаратов, а также живых неокрашенных микроорганизмов в висячей или раздавленной капле.
Для длительного наблюдения за живыми бактериями применяют специальные камеры (Пешкова, Фонбрюна). Микроскопическое исследование позволяет определить форму, размеры и строение микроорганизмов, их взаимное расположение, подвижность, количество и распределение жгутиков, форму и положение спор, а также образование капсул. Для изучения подвижности берут молодые (не старше 6—8 час.) быстрорастущие бульонные культуры. Жгутики легче обнаруживаются в молодых агаровых культурах, споры, наоборот, в культурах, выращенных в течение нескольких суток, а капсулы — в патол, экссудатах. При микроскопии висячей капли лучше пользоваться темным полем или фазово-контрастным устройством. При этом следует учитывать, что формы и размеры микроорганизмов изменяются в зависимости от особенностей штамма, возраста культуры, состава среды, температуры инкубации и других факторов.
Тинкториальные свойства микробов определяют при окраске фиксированных препаратов. Окраска по Граму позволяет разделить все бактерии на 2 группы: грамотрицательные и грамположительные (см. Грама метод). Окраска по Цилю— Нельсену дает возможность дифференцировать кислотоустойчивые бактерии от некислотоустойчивых (см. Циля-Нельсена метод). С помощью специальных методов выявляют отдельные элементы бактериальной клетки: нуклеоид, протоплазму и включения (методы Романовского— Гимзы, Фейльгена, Робино и др.), метахроматические гранулы (см. Нейссера методы и др.), жгутики, капсулы и споры. Метод флюоресцирующих антител делает возможным предварительное определение вида и даже типа микроба (см. Иммунофлюоресценция) .
В случаях специфичности морфологии микроба путем микроскопического исследования можно предположительно идентифицировать его. В мед. микробиологии такого рода идентификация обоснована только тогда, когда она соответствует клин, диагнозу. Так, напр., кислотоустойчивые палочки в цереброспинальной жидкости больного с клин, симптомами менингита можно предварительно отнести к туберкулезным микобактериям. Грамотрицательные биполярно окрашивающиеся овоидные палочки в соке лимф, узлов больного с паховыми бубонами в местности, где распространена чума, можно рассматривать предположительно как чумные бактерии.
Культуральные свойства указывают на принадлежность микроба к определенной группе и намечают направление дальнейших исследований в целях его окончательной идентификации. Их определяют путем посева изучаемой культуры на питательные среды (агар, бульон, уколом в желатину и др.)
Из культуральных признаков бактерий и грибков важное значение имеют внешний вид и внутреннее строение колоний, формирующихся при высеве культуры на плотные питательные среды. Если микроб не дает роста на обычном мясопептонном агаре, то должна быть применена другая, оптимальная для него среда
Колонии обычно просматривают через 24 часа инкубации при t° 37°, а затем повторно с интервалом в 1 — 3 дня
При описании колоний обращают внимание на их размеры, цвет (пигментообразование), форму, профиль, поверхность, края, плотность. Если бактерии проявляют тенденцию к диссоциации на фазовые варианты (см
Диссоциация бактерий), то их разделяют путем рассева на чашках Петри с питательной средой. При росте на жидких питательных средах отмечают придонность роста, рост в виде пленки или равномерное помутнение среды. В некоторых случаях изучается рост на специальных средах, таких как сыворотка Леффлера, глицериновый картофель, среды, содержащие кровь, и др. Культуральные свойства микроба являются существенным дополнением к его морфол, признакам.
Процедура взятия мазка на флору
Тщательность забора материала у женщин играет особую роль, поскольку в случае несоблюдения алгоритма результат исследования мазкого содержимого может оказаться ложным. В случае некоторых заболеваний, например, хламидиоза, возбудители инфекции локализуются в цервикальном канале и отсутствуют в самом влагалище.
Для проведения процедуры используются два предметных стекла, предварительно обработанных эфиром для обезжиривания и ликвидации лишних налетов. На стеклах специальным карандашом наносится маркировка уретры, шейки матки, влагалища (U, C, V соответственно). Как было сказано ранее, взятие мазка предшествует некоторым видам диагностики: мануальному осмотру, кольпоскопии, лечебным манипуляциям во влагалищной зоне и так далее.
Первоначально берется мазкий материал из уретры. Ее массируют пальцем, в результате чего возможно осуществить забор содержимого. Первые выделения удаляются ватным шариком, последующие забираются для исследования методом легкого поскабливания ложечкой Фолькмана — специализированным шпателем, обязательно стерильным. Содержимое, полученное в результате поскабливания, наносится на стекла с соответствующей маркировкой. Далее вводится зеркало, обнажается шейка матки, протирается ватным шариком. Новым шпателем собирают содержимое из цервикального канала (также методом поскабливания). В окончании процедуры производится забор содержимого заднего свода влагалища. Взятые мазки также наносятся на предметные стекла в соответствии с маркировками. Перед отправкой в лабораторию для микроскопии мазки высушиваются на открытом воздухе.
Важно соблюдать стерильность на каждом этапе взятия материала. Обязательно использование именно отдельных шпателей
Перчаткой мануально осуществить забор материала нельзя. Процедура проходит безболезненно и практически неощутимо для пациентки.
Разрешающая способность
Степень проникновения в микромир, его изучения зависит от возможности рассмотреть величину микроэлемента, от разрешающей способности микроскопа. Чаще всего под разрешением микроскопа понимают минимальное расстояние между различимыми объектами.
При превышении увеличения при котором достигается возможное разрешение, границы деталей изображения сливаются. Дальнейшее увеличение изображения образца теряет смысл.
Гораздо более высокое разрешение имеют электронные микроскопы. В 2011 году лучшее разрешение для Растрового электронного микроскопа было 0,4 нм, и лучшее разрешение Просвечивающего электронного микроскопа было 0,05 нм.
Антигенная структура и отношение к бактериофагу
Антигенная структура и отношение к бактериофагу и бактерицинам изучаются на завершающем этапе И. м. Выявление антигенного строения микробов осуществляют при помощи различных серол, реакций, напр, реакции агглютинации (см.), реакции связывания комплемента (см.) и др.
Если в развернутой реакции агглютинации испытываемый микроб агглютинируется до титра иммунной сыворотки или половины титра, то на практике его можно считать принадлежащим к тому виду (типу), каким обозначена данная сыворотка. Для полной идентификации выделенный возбудитель должен агглютинироваться до титра иммунной сывороткой, приготовленной против эталонного микроба: испытуемый микроб должен адсорбировать из этой сыворотки все агглютинины. С другой стороны, эталонный микроб должен агглютинироваться до титра сывороткой, приготовленной против изучаемого микроба, и также адсорбировать из этой сыворотки все агглютинины. Иными словами, должна быть полная перекрестная агглютинация и перекрестная адсорбция между обеими сыворотками и обоими микробами. Реакция агглютинации иногда дополняется или заменяется реакцией преципитации (см.), а также реакцией непрямой гемагглютинации (с эритроцитами, нагруженными антителами). Серол, метод обнаруживает тончайшие различия между родственными микробами. Он часто является единственно доступным методом для дифференцирования подвидов или типов данного вида.
Широкое применение в лабораторной практике получили агглютинирующие монорецепторные сыворотки для идентификации сальмонелл, шигелл и других микробов. Весьма эффективно также применение метода иммунофлюоресценции (см.), который позволяет быстро (1 — 2 часа) осуществить И. м.
Чувствительным методом И. м. является типирование идентифицирующей культуры бактериофагом (см.). Этот метод используется, напр., при изучении брюшнотифозной палочки (см. Vi-брюшнотифозные фаги), т. к. позволяет распознавать фаготип в пределах вида. Специфические фаги применяют для дифференцирования шигелл, холерных вибрионов от холероподобных, классического холерного вибриона от вибриона Эль-Тор, чумной палочки от бактерий псевдотуберкулеза и других бактерий.
Для дифференцирования некоторых бактерий в пределах вида используют феномен бактериоциногении (см.), а также испытание чувствительности бактерий к бактерицинам различных типов (колицины, вибриоцины, пестицины, дифтериоцины и др.). Колицинотипирование нашло широкое применение для определения принадлежности выделенной культуры шигелл к определенному колицинотипу.
Электронная микроскопия
Электронный микроскоп. Модель 1960-х годов
В электронной микроскопии для построения изображения вместо световых лучей используется пучок электронов. Это позволяет увеличить разрешающую способность электронного микроскопа по сравнению со световым в сотни раз.
Первый работоспособный прототип электронного микроскопа был построен в 1932 году Э. Руска и М. Кнолль; в 1986 году за эту разработку Руски, вместе с другими разработчиками электронных микроскопов, была присуждена Нобелевская премия по физике. Серийное производство электронных микроскопов было начато в конце 30-х годов.