Персональное лекарство от рака. как гены пациента влияют на успех лечения
Содержание:
Возрастающая роль сигнального пути RAS в индивидуализированной терапии мКРР
Самым известным биомаркером в таргетной анти-EGFR терапии пациентов c мКРР является статус мутаций кодонов 12 и 13 гена KRAS. Доказано, что активация KRAS за счет мутации сводит на нет эффект ингибирования EGFR моноклональными антителами. Таким образом, наличие мутантных аллелей гена KRAS является независимым предсказательным маркером эффективности терапии ингибиторами EGFR. Поэтому панитумумаб и цетуксимаб назначают только больным мКРР с диким типом гена KRAS.
Влияние дополнительных мутаций гена KRAS и новых мутаций гена NRAS, а также мутаций гена BRAF на эффективность таргетной терапии ингибиторами EGFR изучалось в исследованиях с панитумумабом и цетуксимабом пациентов мКРР:
- Анализ мутаций генов KRAS/NRAS и мутации гена BRAF в исследовании 3 фазы PRIME: комбинации панитумумаб+FOLFOX4 в сравнении с FOLFOX4 в 1-й линии терапии метастатического колоректального ракаOliner K, Douillard JY, Siena S, et al. Analysis of KRAS/NRAS and BRAF mutations in the phase III PRIME study of panitumumab (pmab) plus FOLFOX versus FOLFOX as first-line treatment (tx) for metastatic colorectal cancer (mCRC). ASCO 2013 (poster discussion): 3511
- Анализ мутаций генов RAS/RAF в исследовании 2 фазы PEAK: комбинации панитумумаба с mFOLFOX6 в сравнении с бевацизумабом в комбинации с mFOLFOX6 в 1-й линии терапии пациентов с метастатическим колоректальным раком с WTKRASSchwartzberg LS, Rivera F, Karthaus M, et al. PEAK (study 20070509): A randomized phase II study of mFOLFOX6 with either panitumumab (pmab) or bevacizumab (bev) as first-line (tx) in patients (pts) with unresectable wild type (WT) KRAS metastatic colorectal cancer (mCRC). J Clin Oncol 2013; 30 (Suppl 34): 446
- Анализ влияния мутаций генов семейства RAS (2 экзона KRAS и других RAS-мутаций) в исследовании CRYSTAL: комбинации цетукпсимаба с FOLFIRI в сравнении с FOLFIRI в 1-й линии терапии пациентов с метастатическим колоректальным раком на выживаемость пациентов без прогрессии и общую выживаемостьVan Cutsem et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015 Mar 1; 33(7): 692-700
Все исследования показали, что, несмотря на то, что индивидуализация терапии антителами по статусу генов семейства RAS предусматривает сужение круга пациентов (примерно 50/50 вместо 60/40 при отборе только лишь по статусу 2 экзона гена KRAS), пациенты с диким типом генов KRAS и NRAS в опухоли получат максимальную пользу от терапии антителами в комбинации со стандартной химиотерапией, по сравнению с пациентами без мутаций гена KRAS во 2 экзоне. Пока нет достаточных доказательств негативного влияния мутаций генов BRAF, PI3K, PTEN и других участников сигнального пути RAS-RAF-MEK-ERK-МАРК по результатам крупных проспективных рандомизированных исследований, однако не исключено, что появление таких исследований вновь существенно изменит наши представления о группе пациентов, для которых применение анти-EGFR антител окажется наиболее выгодным.
В связи с этим целью программы является максимально широкое внедрение генетического тестирования при колоректальном раке в ежедневную практику онкологов, как одного из важнейших условий проведения современной эффективной терапии у целевой группы пациентов.
Список литературы:
- Heldin CH. Dimerization of cell surface receptors in signal transduction. Cell 1995; vol.80, no.2, pp.213-223.
- Carpenterand G, Cohen S. Epidermal growth factor. J Biol Chem, 1990; vol.265, no.14, pp.7709-7712.
- Citri A, Yarden Y. EGF-ERBB signalling: towards the systems level. Nature Rev Molecular Cell Biol 2006; vol.7, no.7, pp.505-516.
- Boguski MS, McCormick F. Proteins regulating Ras and its relatives. Nature 1993; 366: 643-654.
- Vakiani E, Solit DB. KRAS and BRAF: drug targets and predictive biomarkers. J Pathol 2011; 223: 219-229.
- Edkins S, O’Meara S, Parker A, et al. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5: 928-932.
- Janakiraman M, Vakiani E, Zeng Z, et al. Genomic and biological characterization of exon 4 KRAS mutations in human cancer. Cancer Res 2010; 70: 5901-5911.
- Soh J, Okumura N, Lockwood WW, et al. Oncogene mutations, copy number gains and mutant allele specific imbalance (MASI) frequently occur together in tumor cells. PLoS One. 2009, 14, no.4(10). P.7464.
Войтив базу данных
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Регистрацияв программе
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Методы изучения
Анализ природы И. и передачи измененных признаков из поколения в поколение служит главным средством изучения механизма наследственности (см.). Внешне неразличимые фенотипы в одинаковых условиях среды в одних случаях могут быть результатом изменения генотипа, а в других— результатом ненаследственных модификаций. Без генетического анализа (см.) нельзя определить, какая доля фенотипической И. обусловлена ненаследственными модификациями и какая генетическими факторами. Если популяция состоит из особей с идентичными генотипами, то искусственный отбор (см.) в такой популяции будет бесперспективен, т. к. вся наблюдаемая фенотипическая И. обусловлена влиянием среды. Некоторые ламаркисты ошибочно полагали, что негенетические модификации, так наз. благоприобретенные признаки, могут превращаться в наследственные изменения. Такая точка зрения не была подтверждена и представляет сейчас лишь исторический интерес. Данные 60— 70-х гг. 20 в. показывают, что превращение модификаций в наследственные изменения совершенно невозможно. По мере развития генетики (см.) стало ясно, что противопоставление мутаций (крупных качественных изменений признаков) флюктуациям (мелким количественным вариациям) совершенно ошибочно. Мутации могут затрагивать любые признаки организма, на любой стадии его развития, и притом самого различного таксономического значения. Анализ причин и развитие точных количественных вариационно-статистических способов оценки И. показали, что мутации могут лежать в основе ничтожных количественных отклонений, внешне ничем не отличимых от ненаследственных модификаций. Для выявления относительной роли среды и генотипа в формировании того или иного признака используют два основных взаимодополняющих метода: один из них заключается в исследовании генотипически различных особей в как можно более одинаковой окружающей среде, а другой — в изучении генетически идентичных особей в разных условиях среды. Оба метода легко применить к таким организмам, как бактерии и дрожжи, которые в результате многократно повторяющихся делений образуют генетически идентичные клоны. У многих высших растений клоны можно получить путем бесполого размножения (клубнями, луковицами, черенками и т. п.). Напр., все растения одного сорта картофеля генетически идентичны, и поэтому различия между ними обусловлены внешними факторами. Если же два разных сорта картофеля выращивать в одинаковых условиях, то различия между растениями будут связаны с различиями в их генотипах. У животных клоны генетически идентичных особей можно получить в результате тесного и продолжительного инбридинга (см.). Для выявления роли наследственности и среды в формировании различных признаков у человека с успехом используют близнецовый метод (см.). Исследования на монозиготных близнецах, имеющих идентичную наследственность и воспитывающихся порознь, дают ценные сведения о влиянии среды на развитие наследственных признаков. При анализе прерывистой (качественной) И., обусловленной аллелями одного генного локуса, определить характер наследования и вклад в общую И. наследственных и средовых факторов обычно не представляет большого труда. В случае непрерывной (количественной) И. исследователь сталкивается со значительными трудностями. При изучении какого-либо количественного признака проводят анализ возможно большего числа различающихся между собой особей и полученные данные группируют в ряд размерных классов. Представив эти величины в виде графика распределения частот, можно исследовать характер И. Обычно бывает трудно разделить генетические и средовые компоненты изменчивости и исследовать отдельно ту ее часть, к-рая обусловлена генетически. Для изучения этих компонентов разработаны различные математико-статистические методы (см. Биометрия).
Модели мутагенеза
В настоящее время существует несколько подходов для объяснения природы и механизмов образования мутаций. Общепринятой, в настоящее время, является полимеразная модель мутагенеза. Она основана на идее о том, что единственной причиной образования мутаций являются случайные ошибки ДНК-полимера. В предложенной Уотсоном и Криком таутомерной модели мутагенеза впервые была высказана идея о том, что в основе мутагенеза лежит способность оснований ДНК находиться в различных таутомерных формах. Процесс образования мутаций рассматривается как чисто физико-химическое явление. Полимеразно-таутомерная модель ультрафиолетового мутагенеза опирается на идею о том, что при образовании цис-син циклобутановых пиримидиновых димеров может изменяться таутомерное состояние входящих в них оснований. Изучается склонный к ошибкам и SOS-синтез ДНК, содержащей цис-син циклобутановые пиримидиновые димеры. Существуют и другие модели.
Полимеразная модель мутагенеза
В полимеразной модели мутагенеза считается, что единственной причиной образования мутаций являются спорадические ошибки ДНК-полимераз. Впервые полимеразная модель ультрафиолетового мутагенеза была предложена Бреслером. Он предположил, что мутации появляются в результате того, что ДНК-полимеразы напротив фотодимеров иногда встраивают некомплементарные нуклеотиды. В настоящее время такая точка зрения является общепринятой. Известно А-правило (A-rule), согласно которому напротив поврежденных участков ДНК-полимераза чаще всего встраивает аденины. Полимеразная модель мутагенеза объясняет природу мишенных мутаций замены оснований.
Таутомерная модель мутагенеза
Уотсон и Крик предположили, что в основе спонтанного мутагенеза лежит способность оснований ДНК переходить при некоторых условиях в неканонические таутомерные формы, влияющие на характер спаривания оснований
Эта гипотеза привлекала к себе внимание и активно развивалась. Обнаружены редкие таутомерные формы цитозина в кристаллах оснований нуклеиновых кислот, облученных ультрафиолетовым светом
Результаты многочисленных экспериментальных и теоретических исследований однозначно говорят о том, что основания ДНК могут переходить из канонических таутомерных форм в редкие таутомерные состояния. Было выполнено много работ посвященных исследованиям редких таутомерных форм оснований ДНК. С помощью квантовомеханических расчетов и метода Монте-Карло было показано, что таутомерное равновесие в цитозин — содержащих димерах и в гидрате цитозина сдвинуто по направлению к их имино формам как в газовой фазе, так и в водном растворе. На этой основе объясняется ультрафиолетовый мутагенез. В паре гуанин — цитозин устойчивым будет только одно редкое таутомерное состояние, в котором атомы водородов первых двух водородных связей, отвечающих за спаривание оснований, одновременно изменяют свои положения. А поскольку при этом изменяются положения атомов водорода, участвующих в Уотсон-Криковском спаривании оснований, то следствием может быть образование мутаций замены оснований, транзиций от цитозина к тимину или образование гомологичных трансверсий от цитозина к гуанину. Участие редких таутомерных форм в мутагенезе обсуждалось неоднократно.
Другие модели мутагенеза
В работах Полтева с соавторами предложен и обоснован молекулярный механизм узнавания полимеразами комплементарных пар оснований нуклеиновых кислот. На основании этой модели были изучены некоторые закономерности спонтанного и индуцированного аналогами оснований мутагенеза. Объяснено образование мутаций замены оснований в предположении, что главной причиной мутагенеза является образование неканонических пар оснований, типа Хугстиновских пар..
Предполагается, что одной из причин образования мутаций замены основания является дезаминирование 5-метилцитозина, что может вызывать транзиции от цитозина к тимину. Из-за дезаминирования цитозина напротив него в цепь ДНК может включаться урацил (образуется пара У-Г вместо канонической пары Ц-Г). При репликации ДНК напротив урацила в новую цепь включается аденин, образуется пара У-А, а при следующей репликации она заменяется на пару Т-А, то есть происходит транзиция (точечная замена пиримидина на другой пиримидин или пурина на другой пурин).
Как протекает процесс мутагенеза
Механизм образования мутаций происходит так:
- повреждается ДНК. В случае, когда повреждение не восстановлено, происходит мутация;
- если при повреждении фрагмента ДНК и при вырождении генетического кода не происходит нарушения, то возникают мутации, которые впоследствии окажутся незначительными или вовсе не проявятся.
Мутант — это организм, во всех клетках которого произошли мутации. Он начинает развиваться из мутационной клетки — гаметы или зиготы. Часто мутация образуется не во всех соматических клетках — такой организм получил название генетическая мозаика.
В случае, если изменения произошли в генеративных клетках (гаметы, споры, клетки зародышевого пути), такой организм не будет считаться мутантом, но передаст часть мутаций наследникам.
Мутации возникают не сразу, т.к. их образованию предшествует предмутационное состояние. Репарационные системы стараются убрать такое состояние.
Определение
Репарационные системы — это ферменты и ферментативные реакции, способствующие восстановлению правильной структуры ДНК.
Репарационные системы основаны на разных ферментах, заключенных в генотипе клетки. Они препятствуют возникновению мутаций.
Примеры мутации
Серповидно-клеточная анемия и малярия
Серповидно-клеточная анемия, вызванная так называемым серповидным эффектом на красном кровь клетки, как правило, проявляется через сгустки крови, анемию и приступы боли, известные как «серповидноклеточные кризы». Хотя многие из этих симптомов можно лечить с помощью лекарств, они все же значительно снижают качество жизни своих носителей.
Несмотря на то, что SCD считается редким явлением и является мутацией, он относительно хорошо изучен. Это происходит в 11-й хромосоме и катализируется наследованием ненормального гена гемоглобина от обоих родителей. Что касается глобальной распространенности, SCD является наиболее распространенным среди населения Западной Африки, с уровнем заболеваемости около 4,0%
Исследования показывают, что распространенность ВСС в Западной Африке не является случайным явлением. Несмотря на его влияние на здоровье, было также показано, что ВСС снижает риск заражения малярией от комаров. Поскольку климат Западной Африки позволяет процветать малярии, SCD служит средством защиты Население.
В целом, SCD служит примером генетической мутации, приносящей пользу популяциям, на которые он влияет. Отчасти именно поэтому некоторые генетические мутации сохраняются в течение десятилетий и даже столетий.
Клинфельтерс Каликос
Синдром Клайнфелтера, также известный как синдром XXY, представляет собой генетическую мутацию, при которой у субъекта мужского пола имеется дополнительная Х-хромосома, следовательно, у женщины генотип XX в дополнение к традиционному мужскому генотипу XY. Кроме того, мужчины с синдромом Клайнфелтера часто имеют женские особенности, такие как грудь ткань и, возможно, не сможет воспроизвести.
Как это лежит в генетический код, который гомологичны между большинством вид Синдром Клайнфелтера не является исключительным для людей. Следовательно, кошки, собаки и даже киты могут наследовать генотип XXY.
У кошек Х-хромосома несет в себе больше информации, чем пол. Цвет меха, например, переносится на Х-хромосому.
Кроме того, цвет меха является доминантным. Поскольку кошки мужского пола обычно наследуют только одну Х-хромосому, а кошки женского пола наследуют две Х-хромосомы, кошки женского пола с большей вероятностью имеют разноцветные рисунки меха, чем кошки мужского пола.
Это особенно верно для ситца, кота, известного своим поразительным оранжево-черным мехом. Ген черного меха не может переноситься на той же Х-хромосоме, что и ген оранжевого меха, что делает ситцевых кошек почти исключительно самкой.
Однако это не делает невозможным существование мужского ситца. Самцы кошек с двумя Х-хромосомами или генотипом XXY вполне могут нести ген оранжевого меха на одной Х-хромосоме и ген черного меха, с другой. Таким образом, они действительно являются «Каликфельтерским Калико».
Толерантность к лактозе
Ранее мы упоминали, что SCD, мутация, отмеченная иногда опасными для жизни физическими симптомами, также помогает предотвратить малярию в Западной Африке. Толерантность к лактозе – еще одна мутация, которая приносит пользу тем, у кого она есть.
Человеческие тела изначально не могли производить лактаза энзим, который переваривает белки в коровьем молоке после первых месяцев жизни. Это потому, что люди часто не употребляли молоко – или другие молочные продукты, в этом отношении – в зрелом возрасте.
Рост пастеризации, а также коммерческого сельского хозяйства, почти покончил с этой старой привычкой. Как мы видим сегодня, люди всех возрастов едят сыр и пьют молоко. Конечно, это происходит после значительных телесных изменений. Мутация, которая продлевает выработку лактазы у людей, которая в настоящее время более распространена в западных странах, позволяет людям есть молочные продукты без желудок боль или тошнота.
Как и при SCD, эта мутация сохраняется, потому что она помогает людям потреблять жизненно важные питательные вещества, такие как кальций и калий, из более разнообразных источников.
- хромосома – Часть ДНК, которая несет генетическую информацию.
- Гомологичные – Наличие одинаковых функций или структуры внутри тела или между двумя видами.
Сложность в том, что каждая опухоль уникальна по своему набору «мишеней»-мутаций
Так же, как уникален код ДНК у каждого человека — неповторимы и опухоли. Ведь они «рождены» из собственных клеток организма. Не существует опухолей с одинаковыми генно-молекулярными свойствами. Поэтому создать универсальную «таблетку» от рака — принципиально невозможно. Рак — слишком индивидуальное заболевание.
Но и лечение для него должно быть соответствующее — индивидуально подобранное для конкретного пациента — на основе того, что мы определяем мутации в его опухолевых клетках.В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
Чтобы эффективно использовать таргетную терапию, этого мало. Врач должен знать, какие мутации есть в опухолевых клетках у конкретного пациента, присутствуют ли в них биомаркеры-«мишени» для того или иного препарата. Персонализированная медицина, как она есть.
Для этого мы и применяем молекулярно-генетические исследования. Чтобы найти «мишени», по которым нужно прицельно бить таргетными и иммунотреапевтическими препаратами — нужно определить, из каких генов собрана ДНК опухоли, и какие гены в ней — «сломаны». В результате:
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
- обнаружим опухоль/метастаз на очень ранней стадии — по обрывкам ее ДНК в крови;
- можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия — микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови — тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль — опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла — от кожи до опухоли — так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Там из образца выделяют опухолевую ДНК и секвенируют ее. То есть — «прочитывают» последовательность «букв»-нуклеотидов. А затем сравнивают с диагностической панелью, отобранной из базы библиотек — уже расшифрованных геномов тысяч других людей. Панель подбирают под каждого пациента — с учетом анамнеза и клинических данных. Все это, разумеется, делают автоматические секвенаторы и компьютер.
И если 20 лет назад «чтение» генома занимало месяцы, требовало медленной и сложной расшифровки, то сегодня в лаборатории, с которой мы сотрудничаем, делают анализ за несколько рабочих дней.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации — то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии — и даже визуализировать весь кариотип (хромосомный набор).
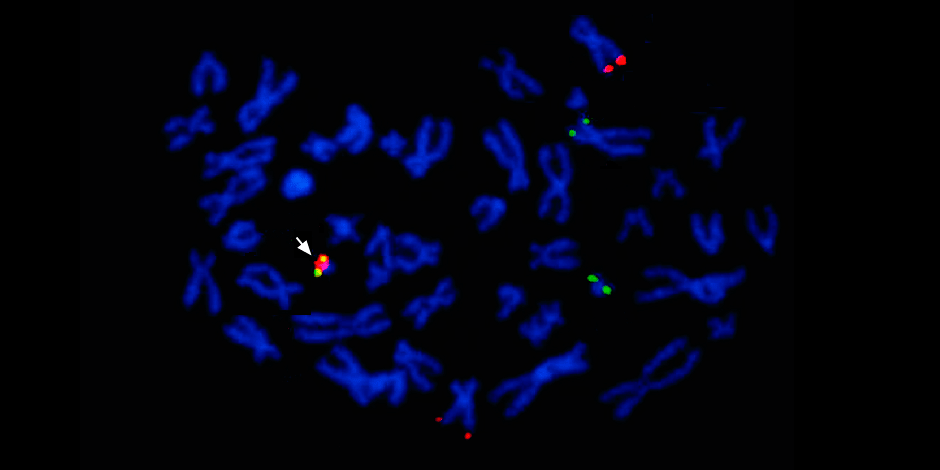
Под стрелкой слева — слияние красного и зеленого сигнала — свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) — нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
Примеры мутаций
Самые прочные кости в мире
Например, ген LRP5 отвечает за плотность костей. Его мутация может привести к снижению плотности костной ткани или, наоборот, подарить вам несокрушимые кости. Одна семья в Коннектикуте (США), как оказалось, имеет мутации LRP5, которые дают их костям такую плотность, что те практически неразрушимы. Никто из них никогда не ломал кость. Увеличенная сила костей, в особенности позвоночника, черепа и таза, дает членам этой семьи самые прочные скелеты на Земле.
Как спать по 4 часа в день
Другой ген, DEC2, отвечает за регулирование количества сна, необходимое нам каждую ночь, чтобы правильно функционировать. Большинству из нас нужно восемь часов сна или больше, но около 5% населения наслаждаются несколько иной «мутантной» версией. Испытания, проведенные на матери с дочкой, у которых были мутации, выявили способность спать всего 4-6 часов каждую ночь. Простые смертные начали испытывать негативные последствия уже через пару дней такого сна, но мутанты переносят это вполне нормально. Теперь ученые хотят скопировать эту мутацию для других людей, но пока у них это не сильно получается.
Иммунитет к электричеству
А некоторые люди из-за генной мутации вообще имеют иммунитет к электричеству. Обычный человек покрыт миллионами потовых желез, которые обычно прокладывают для электрошока удобный влажный путь прямо в нашу кожу. Однако один житель Сербии не имеет потовых или слюнных желез из-за редкого генетического заболевания. Это означает, что электричество не может проникнуть в его тело. Он может подзарядить телефон, чтобы почитать наш Telegram-чат, приготовить пищу, вскипятить воду и даже поджечь что-нибудь, пропуская электричество через свое тело, чем установил несколько рекордов и появился на нескольких телевизионных шоу.
Иммунитет к ядам
На протяжении сотен лет жители Сан-Антонио де лос Кобрес в Аргентине попивали горную воду, уровень мышьяка в которой превышает безопасный в 80 раз. Несмотря на чрезвычайное повседневное воздействие смертоносного металла, жители остаются абсолютно здоровыми. И все благодаря мутантному гену AS3MT, который прошел через тысячи лет естественного отбора. Он позволяет телу обрабатывать мышьяк, не позволяя ему накапливаться в опасных концентрациях, поэтому владельцы этих микроскопических мутантов могут поедать столько мышьяка, сколько им вздумается.
Ученые продолжают активно изучать мутации у человека и животных — одни считают, что это поможет вылечить многие болезни, а другие увлечены идеей создания «сверхчеловека». За счет мутаций он сможет быть невероятно сильным, быстро бегать, иметь иммунитет к электричеству и ядам и многое другое. Однако пока неизвестно ни одного случая, что эти мутации могут сосуществовать вместе. Все же реальная жизнь — это не кино или комикс про супергероев, чудес здесь не бывает. Хотя некоторые мутации и можно к ним отнести.