Жир
Содержание:
- Биологическая роль семейства пренилированых коротких ГТФаз
- Пренилированные протеины
- Биосинтез триглицеридов
- Пути эндогенного биосинтеза кометаболитов ХС
- Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
- Реабилитация Жира! Классификация пищевых жиров и в каких продуктах они есть
- Образование мицелл
- Эмульгирование и гидролиз липидов
- Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
- Всасывание липидов
- Заключительный этап биосинтеза
- Обратный транспорт ХС
- Процесс липолиза
- Гистохимические методы определения в тканях
- Ресинтез липидов в энтероцитах
Биологическая роль семейства пренилированых коротких ГТФаз
Короткая ГТФаза является пренилированным протеином, обеспечивающим транслокацию гуанозиндифосфата (ГДФ) в гуанозинтрифосфат (ГТФ), а также играет ключевую роль в контроле за функционированием внутриклеточных сигнальных систем (Greenwood J. et al., 2006). Перед активацией рецептора тирозинкиназы фарнезилированная мембрана связывает короткую ГТФазу, что, в свою очередь, сопровождается активацией протеина Ras посредством его ассоциации с молекулой ГТФ. Протеин Ras рассматривается как промежуточный сигнальный трансдуктор, инициализирующий каскад реакций, способствующих процессам клеточного роста. Короткая ГТФаза вовлекается в процессы биосинтеза органелл клетки и внутриклеточного везикулярного обмена. К настоящему времени уже идентифицированы более 60 изоформ этого фермента. Каждая из них имеет специфическую внутриклеточную локализацию (то есть компартментализирована) и регулирует строго определенный участок везикулярного транспорта. Например, Rab1-изоформа вовлекается в процессы трансфера везикул из эндоплазматического ретикулума в аппарат Гольджи, а Rab8-изоформа транспортирует ресинтезируемые трансмембранные протеины из аппарата Гольджи в цитоплазматическую мембрану (Grosshans B.L. et al., 2006). Вообще, все изоформы ГТФазы подвергаются процессу модификации по механизму геранилгераниляции, которая не только определяет их последующую компартментализацию, но и в значительной степени опосредует функциональную способность (Calero M. et al., 2003; Gomes A.Q. et al., 2003).
Пренилированные протеины
Посттрансляционная модификация (прениляция) белков формируется посредством образования дополнительной ковалентной связи между двумя изопреноидами (ФПФ и ГПФ) и остатками цистеина на С-терминальном конце молекулы. Пренилированные протеины, такие как короткая ГТФаза и ламинины составляют более 2% от общего числа внутриклеточных протеинов (McTaggart S.J., 2006). Липофильный участок молекулы подвергается прениляции, что позволяет модифицированным протеинам прикрепляться к клеточным мембранам. Это в большинстве случаев является необходимым условием для реализации их биологической функции. Селен-цистеин-содержащая тРНК также подвергается посттранскрипционной прениляции, опосредующей функциональную способность молекулы.
Биосинтез триглицеридов
Фундаментальными кирпичиками процесса выступают глицерин и ЖК. Изначально формируется промежуточный продукт – глицерол-3-фосфат. Это характерно для процессов биосинтеза, происходящих в почках и стенках кишечника. Клетки органов отличаются гиперактивностью фермента глицеролкиназы, чего нельзя сказать о мышечной и жировой ткани. Тут вещество формируется при помощи гликолиза – окисления глюкозы.
Эффект особенно проявляется при истощении. Вследствие этого, образуется недостаток глюкозы, что приводит к резкому снижению производства глицерол-3-фосфата. Как результат свободные ЖК не используются на ресинтез липидов, просто покидая ткань.
Еще одним источником промежуточного синтеза глицерол-3-фосфат выступает печень. Орган может производить вещество обоими способами, с использованием как глицерина, так и глюкозы, в качестве базового соединения. Впрочем, для синтеза глицерол-3-фосфат главное, что события произошли, поскольку в дальнейшем соединение ацилируется. То есть происходит процесс введения RCO- остатка при помощи молекул ЖК (КоА производные).
Это приводит к синтезу фосфатидной кислоты. В дальнейшем от полученного соединения отщепляется остаток фосфорной кислоты. Реакция дефосфорилирования протекает с участием фосфатидатфосфатазы. Ее продуктом выступает 1,2-диглицерид. До получения триглицерида остается единственный шаг. Он состоит в этерификации. Кислотой выступает 1,2-диглицерид, заместителем спирта – фермент ацил-КоА.

Пути эндогенного биосинтеза кометаболитов ХС
ХС широко включается в процессы метаболизма, входит в число естественного компонента биологических мембран и рассматривается как основной источник для последующего синтеза стероидных гормонов, витамина D и желчных кислот. Процессы биосинтеза эндогенного ХС осуществляются в эндоплазматическом ретикулуме и цитозоле. Последовательная конденсация трех молекул ацетил-КоА при участии тиолазы и 3-гидрокси-3-метилглутарил-КоА синтетазы (ГМГ-КоА-синтетазы) приводит к образованию ГМГ-КоА. В последующем превращение ГМГ-КоА в мевалонат осуществляется с помощью ГМГ-КоА-редуктазы, а сама реакция рассматривается как ключевая в синтезе эндогенного ХС (рис. 2.5).

Рис. 2.5. Ключевые этапы биосинтеза эндогенного ХС
Одними из важных промежуточных продуктов этого метаболического пути являются геранилпирофосфат (ГПФ) и фарнезилпирофосфат (ФПФ). Они представляют собой дериваты изопентил пирофосфата и его изомера диметилалил пирофосфата, структурно относящиеся к изопреновым производным (McTaggart S.J., 2006). Кроме биосинтеза ХС, ГПФ и ФПФ вовлечены в посттрансляционную модификацию (то есть прениляцию) различных внутриклеточных протеинов, в свою очередь, являющихся прекурсорами для дальнейшего синтеза важных метаболитов, таких как долихол и убихинон.
Регуляция плазменного содержания апо-B-липопротеина в норме и при нарушениях липидного обмена
Концентрация апо-B-содержащих липопротеидов в плазме крови является результатом метаболического регулирования их продукции, изменения клиренса или конверсии. Наиболее типичные виды метаболического регулирования содержания апо-В представлены на рис. 2.4. В физиологических условиях, ЛПОНП1 являются основными липопротеидами, секретирующимися гепатоцитами. Непосредственно после синтеза ЛПОНП1 конвертируются в ЛПОНП2, а последние — в ЛППП, при этом их концентрация в плазме крови сохраняется достаточно низкой именно за счет высокой скорости конвертации. С другой стороны, ЛПНП значительно медленнее выводятся из циркуляции (период циркуляции составляет 2–4 сут), что приводит к относительному преобладанию этого типа липопротеидов по отношению к другим фракциям. С возрастом продукция апо-В-липопротеина обычно повышается, что ассоциируется со снижением экспрессии рецепторов к ЛПНП (Matthan N.R. et al., 2005). При некоторых состояниях, например, при ожирении, синтез ЛПОНП особенно высок, что способствует увеличению плазменного уровня апо-В и ЛПНП (Chan D.C. et al., 2004). Установлено, что повышение уровня ЛПОНП1 может сопровождаться гиперинсулинемией даже у здоровых лиц (Malmstrom R. et al., 1997). При инсулинорезистентности недостаточная регуляция продукции ЛПОНП негативно отражается на плазменном уровне апо-B-липопротеина, что способствует повышению концентрации ЛПОНП, ЛППП, ЛПНП, формируя проатерогенную гиперлипидемию (Taskinen M.R., 2003).

Рис. 2.4. Метаболическая регуляция уровня апо-B-липопротеина в плазме крови. Модифицирован из работы C.J. Packard и соавт., 2000
У лиц со значительным повышением уровня ХС ЛПНП (>4,5 ммоль/л) в плазме крови выявляют увеличение содержания апo-B-липопротеинов преимущественно за счет редукции клиренса рецепторов к ним. Последние представляют собой регулируемые мембранассоциированные протеины, ответственные за распознавание и интернационализацию липопротеинов, а также активное поступление ХС в клетки (Turley S.D., 2004). Снижение экспрессии рецепторов или различные варианты качественного изменения в структуре их субъединиц являются морфологической основой возникновения ряда наследственных нарушений липидного обмена, таких как семейная гиперхолестеринемия (см. главу 6). Необходимо отметить, что концентрация ЛПНП может подвергаться непосредственному метаболическому регулированию со стороны ЛПОНП2, уровень которых, в свою очередь, зависит от ЛПОНП1 (Gaffney D. et al., 2002).
У пациентов с изолированной гипертриглицеридемией обычно отмечают избыточную продукцию ЛПОНП (особенно ЛПОНП1) на фоне неэффективного липолиза (Chan D.C. et al., 2004). Это приводит к повышению содержания апо-В в плазме крови, поскольку последний является транспортной формой как для ЛПОНП1, так и для ЛПОНП2. Кроме того, у таких больных не только существенно снижен клиренс апо-В-содержащих липопротеидов, но и имеется возможность для их более интенсивной модификации. Так, CETP транспортирует ТГ от ЛПОНП к ЛПНП и ЛПВП, тогда как эстерифицированный ХС перемещается в обратном направлении. При этом апо-C-II, апо-C-III и апо-Е поочередно включаются в состав липопротеидов, заменяя друг друга. Все это приводит к тому, что в длительно циркулирующих в плазме крови молекулах ЛПОНП снижается содержание aпo-C-липопротеина, тогда как удельный вес aпo-E и эстерифицированного ХС возрастает. Подобная модификация ЛПОНП способствует появлению резистентности последних к липазе и обусловливает формирование так называемых ремнантных форм ЛПОНП (Havel R.J., 2000).
Реабилитация Жира! Классификация пищевых жиров и в каких продуктах они есть
28.09.201420:10
Диетологи реабилитировали сливочное масло и другие жиры! В конце июня 2014 года на обложке журнала Time появился аппетитный кусок – сливочного масла, и призыв его есть!Эксперимент с обезжиренными продуктами, который был запущен в 70-е годы 20 века американскими диетологами «не оправдал» ожидания: заболеваемость ожирением и сахарным диабетом с годами только возрастала . Отмечено, что люди активно ограничивающие жиры в рационе начинают больше «злоупотреблять» углеводами (а это злаковые, крупы, также фрукты и овощи с высоким гликемическим индексом, более 50.)При употребление обезжиренных продуктов очень медленно возникает чувство насыщения, что и чревато перееданием углеводов ( ведь «жиры — это главный вред «, как считали раньше) и превышением калорийности рациона. Жир – он же холестерин, важен для организма, как любой другой продукт, но в «умеренной дозе». Из холестерина, если посмотреть биохимическую цепочку, образуются все половые гормоны (а их дефицит в организме грозит многими проблемами, и не только нарушением цикла, даже бесплодием),образуется фосфолипидная защитная «оболочка» клеток, в том числе «фосфолипидное покрытие» кожи, с помощью жиров усваиваются жирорастворимые витамины А 1(ретинол), витамин Е и микроэлемент — кальций, и гормоновитамины – А2 (дегидроретинол), и т.д.Кроме того, гормон стресса – кортизол образуется из холестерина, а с помощью этого гормона наш организм ежедневно «справляется» со стрессом, а при заболевании — и с воспалением, например, при бронхиальной астме.Когда нарушен жировой обмен — это заметно сразу, девушка может быть стройной, но с «большим» животом или бёдрами. В таком распределении, как правило, есть генетическая предрасположенность, фигура почти точно повторяет фигуру одного из родственников, жир откладывается в зонах определяющих конституцию. Вот в таком случае жиры в рационе надо ограничивать, а если сдать кровь, то в липидограмме можно обнаружить признаки начинающегося атеросклероза: повышено количество холестерина, триглицеридов и/или хиломикронов, так активно «забивающих» печень, мышцы, сосуды и т.д. Но «жиры жирам рознь», и не все жиры одинаковые. РазберёмМононенасыщенные жиры: содержатся в оливковом масле, гусином и утином жире, под приставкой «моно» подразумевается, что этим жирам не надо расщепляться на более простую для всасывания форму, они и так «простые». Используются в организме сразу после всасывания, чаще для получения «энергии» . Рекомендуемая доза оливкового масла в сутки – 2 столовые ложки в холодном виде.Полиненасыщенные жиры – рыбий жир, рапсовое и льняное масло, расщепляются медленнее, используются как основной «строительный материал» для клеток, участвуют в антиоксидантных процессах.Насыщенные жиры – сливочное масло, говяжий жир, баранина, свинина, расщепляются долго, чаще используются организмом «про запас». Рекомендуемая суточная доза сливочного масла — 30 грамм.Жир вреден, когда организм не может его вовремя израсходовать: его или много поступило с едой, или он не «уходит» как поставщик энергии – мало физической нагрузки, не хватает ферментов правильно его усваивающих – липазы, или не хватает соляной кислоты, желчи и т.д. У детей до 10 лет «обезжиривать рацион под ноль» совсем не рекомендуется, так как у ребёнка продолжают формироваться нервные структуры мозга, а их миелиновая оболочка состоит из «жиров»), кроме того, запускается пубертат (и нужны половые гормоны)! Детская диета предполагает ограничение легкоусваиваемых углеводов (сладостей, соков, газировок и т.д.)Жиров в рационе должно быть около 30 % общей суточной нормы, 40% белков, остальное – углеводы.Например, в каждом нижеприведённых вариантов меню завтрака, обеда или ужина, содержится суточная норма «жира», выбирайте: Утро— 1 яйцо + 20 гр сыра + 30 гр сливочного маслаОбед – порция риса бурого 100 гр, салат 100 гр с растительным маслом + 200 гр красной рыбы или 200 гр говядины + 150 гр овощи–грильУжин- 150 гр 5 % творога и кусочек зернового хлеба .. сытно и безобидно для здоровья! подготовлено по материалам Allur,10(2014)
Просмотров:4596
Образование мицелл
В результате воздействия на эмульгированные жиры ферментов панкреатического и кишечного соков образуются 2-моноацилглицеролы, свободные жирные кислоты и свободный холестерол, формирующие структуры мицеллярного типа (размер уже около 5 нм). Свободный глицерол всасывается напрямую в кровь.
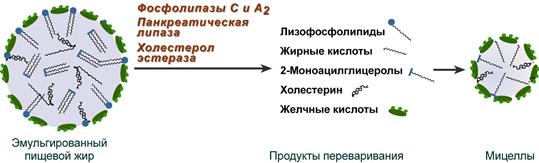
Схематичное изображение переваривания липидов
Полученные смешанные мицеллы достигают эпителия кишечника и их компоненты диффундируют в клетки и попадают в гладкую эндоплазматическую сеть. Желчные кислоты почти не всасываются и остаются в просвете кишечника. Далее желчные кислоты достигают подвздошной кишки и всасываются там ().
Эмульгирование и гидролиз липидов
Первые два этапа переваривания липидов, эмульгирование и гидролиз, происходят практически одновременно. Вместе с этим, продукты гидролиза не удаляются, а оставаясь в составе липидных капелек, облегчают дальнейшее эмульгирование и работу ферментов.
Переваривание в ротовой полости
У взрослых в ротовой полости переваривание липидов не идет, хотя длительное пережевывание пищи способствует частичному эмульгированию жиров.
Переваривание в желудке
Собственная липаза желудка у взрослого не играет существенной роли в переваривании липидов из-за ее небольшого количества и того, что ее оптимум рН 4,5-5,5. Также влияет отсутствие эмульгированных жиров в обычной пище (кроме молока).
Тем не менее, у взрослых теплая среда и перистальтика желудка вызывает некоторое эмульгирование жиров
При этом даже низко активная липаза расщепляет незначительные количества жира, что важно для дальнейшего переваривания жиров в кишечнике, т.к. наличие хотя бы минимального количества свободных жирных кислот облегчает эмульгирование жиров в двенадцатиперстной кишке и стимулирует секрецию панкреатической липазы
Переваривание в кишечнике
Под влиянием перистальтики ЖКТ и составных компонентов желчи пищевой жир эмульгируется. Образующиеся при переваривании лизофосфолипиды также являются хорошим поверхностно-активным веществом, поэтому они способствуют дальнейшему эмульгированию пищевых жиров и образованию мицелл. Размер капель такой жировой эмульсии не превышает 0,5 мкм.
Гидролиз эфиров ХС осуществляет холестерол-эстераза панкреатического сока.
Роль колипазы в действии липазы |
Переваривание ТАГ в кишечнике осуществляется под воздействием панкреатической липазы с оптимумом рН 8,0-9,0. В кишечник она поступает в виде пролипазы, для проявления ее активности требуется колипаза, которая помогает липазе расположиться на поверхности липидной капли.
Колипаза, в свою очередь, активируется и затем образует с липазой комплекс в соотношении 1:1. Панкреатическая липаза отщепляет жирные кислоты, связанные с С1 и С3 атомами углерода глицерола. В результате ее работы остаются 2-моноацилглицеролы (2-МАГ), которые всасываются или превращаются моноглицерол-изомеразой в 1-МАГ. Последний гидролизуется до глицерола и жирной кислоты. Примерно 3/4 ТАГ после гидролиза остаются в форме 2-МАГ и только 1/4 часть ТАГ гидролизуется полностью.
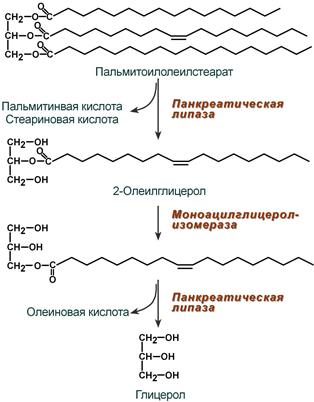
Полный ферментативный гидролиз триацилглицерола
В панкреатическом соке также имеется активируемая фосфолипаза А2, отщепляющая в фосфолипидах жирную кислоту от С2, также обнаружена активность фосфолипазы С и лизофосфолипазы.
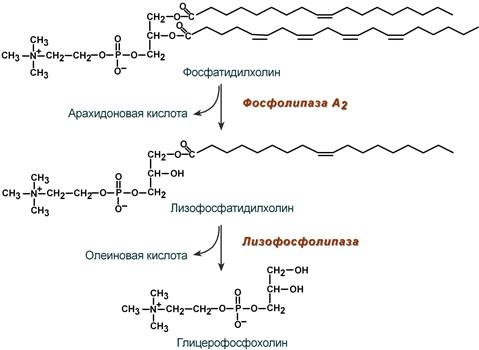
Действие фосфолипазы А2 и лизофосфолипазы на примере фосфатидилхолина
В кишечном соке также имеется активность фосфолипазы А2 и фосфолипазы С.
Для работы всех указанных гидролитических ферментов в кишечнике необходимы ионы Са2+, способствующие удалению жирных кислот из зоны катализа.
Точки действия фосфолипаз
Биологическая роль селен-цистеин-содержащей тРНК и селенсодержащих протеинов
Селен-цистеин-содержащая тРНК является производным изопентенилированного аденозина-37 (A37), обычно опосредованного модификацией антикодона в положении 3′ (Moustafa M.E. et al., 2001). Селен-цистеин-содержащая тРНК декодирует UGA, который в физиологических условиях блокирует кодон и обеспечивает включение молекулы селен-цистеин в формирующиеся селенсодержащие пептиды. Отсутствие изопентенилированной тРНК проявляется в снижении эффективности деградации селен-цистеин-содержащей тРНК в декодированных нечувствительных кодонах бактериальных и дрожжевых клеток (Warner G.J. et al., 2000). Таким образом, неточная трансляция сигнала остановки процесса кодирования может привести к преждевременному завершению процесса протеинового синтеза и сборке короткоцепочечных белковых молекул.
Всасывание липидов
После расщепления полимерных липидных молекул полученные мономеры всасываются в верхнем отделе тонкого кишечника в начальные 100 см. В норме всасывается 98% пищевых липидов.
1. Короткие жирные кислоты (не более 10 атомов углерода) всасываются и переходят в кровь без каких-либо особенных механизмов. Этот процесс важен для грудных детей, т.к. молоко содержит в основном коротко- и среднецепочечные жирные кислоты. Глицерол тоже всасывается напрямую.
2. Другие продукты переваривания (длинноцепочечные жирные кислоты, холестерол, моноацилглицеролы) образуют с желчными кислотами мицеллы с гидрофильной поверхностью и гидрофобным ядром. Их размеры в 100 раз меньше самых мелких эмульгированных жировых капелек. Через водную фазу мицеллы мигрируют к щеточной каемке слизистой оболочки. Здесь мицеллы распадаются и липидные компоненты диффундируют внутрь клетки, после чего транспортируются в эндоплазматический ретикулум.
Желчные кислоты также здесь могут попадать в энтероциты и далее уходить в кровь воротной вены, однако бóльшая их часть остается в химусе и достигает подвздошной кишки, где всасывается при помощи активного транспорта.
Заключительный этап биосинтеза
Оказавшись в цитоплазме метаболит готов к производству прекурсора ЖК – малонил-КоА. Для этого ацетил-КоА и требуется двуокись углерода. Катализатором процесс выступает фермент ацетил-КоА-карбоксилазы. Биосинтез распределяется на два периода:
- Карбоксилирование биотин-энзима. Протекает в присутствии CO2 и АТФ.
- Перенос карбоксильной группы на метаболит.
Результирующий малонил-КоА в дальнейшем быстро трансформируется в ЖК. Процесс происходит с участием определенной ферментной системы. Фактически, это комплекс взаимосвязанных ферментов. Он именуется синтетаза жирных кислот, имеет 6 различных ферментов и связующий элемент – ацилпереносящий белок (осуществляют роль, аналогичную КоА).

Обратный транспорт ХС
Обратный транспорт ХС — позитивный процесс, с помощью которого он возвращается из периферических тканей в печень для дальнейшего катаболизма (см. рис. 2.2). По современным представлениям, незрелые частицы ЛПВП — хорошие акцепторы свободного ХС. Свободный ХС на поверхности ЛПВП эстерифицируется с образованием эфиров ХС. В роли катализатора эстерификации свободного ХС выступает фермент лецитин-холестерин-ацетилтрансфераза (ЛХАТ), а в качестве кофактора — апопротеин А1, структурный белок ЛПВП (Matsuura F. et al., 2006). Образованные эфиры ХС перемещаются с поверхности частиц ЛПВП в гидрофобное ядро, освобождая, таким образом, дополнительную поверхность для свободного ХС (Tall A.R., 2008). По мере накопления в ядре эфиров ХС, дисковидные частицы ЛПВП преобразуются в сферические, богатые ХС ЛПВП. Эфиры ХС из ЛПВП и содержащих апопротеин В липопротеидов захватываются гепатоцитами через рецептор-опосредованный эндоцитоз или с помощью скавенджер-рецепторов макрофагов/фагоцитов (O’Connell B.J. et al., 2004). Кроме того, эфиры ХС транспортируются от ЛПВП к липопротеидам других классов с помощью специфического белка-переносчика — протеина, транспортирующего эстерифицированный ХС (cholesteryl ester transfer protein — CETP). Мутация гена CETP, приводящая к потере физиологической функции последнего, способствует аккумуляции эфиров ХС в ЛПВП с повышением концентрации последних (Shimoji E. et al., 2004). Кроме того, в молекуле ЛПВП возрастает содержание апо-А1-липопротеина, неэстерифицированного ХС и фосфолипидов. В результате возникает метаболическое ремоделирование ЛПВП, инициирующее интенсивность транспорта ХС с помощью апо-В100-содержащих липопротеидов, в том числе ЛПНП. Это отражает существование тесной взаимосвязи между апо-Е/ABCA1- и CETP-зависимыми процессами транспорта липидов в составе молекул липопротеидов различной плотности (рис. 2.3).

Рис. 2.3. Взаимосвязь между апо-Е-/ABCA1- и CETP-зависимыми процессами транспорта липидов в составе молекул липопротеидов различной плотности
Таким образом, основной детерминантой, обеспечивающей интенсивность транспорта, деградации и модификации липидов в составе липопротеидов, является изменение плотности, формы и архитектоники последних в зависимости от характера метаболического регулирования. В свою очередь, этот процесс тесно ассоциирован с особенностями генотипа, фенотипа, пола, возраста и метаболическими потребностями организма в целом.
Процесс липолиза
Жировая ткань – энергетический запас организма. При питании человека часть поступающих с пищей жиров откладывается в различных зонах тела и лица. Это происходит при потреблении большего количества килокалорий, нежели сжигается. Если же наступает период голодания, активного движения и недополучения пищи, то отложенный «запас» перерабатывается.
Липолиз – это расщепление жировой ткани на ее составляющие под действием липазы (фермента). Этот принцип заложен в основу одноименной косметологической аппаратной и мануальной коррекции. Процесс липолиза запускается при проведении процедур несколькими методами: лазерным, ультразвуковым, инъекционным, радиочастотным (RF, РФ-лифтинг). После расщепления жир попадает в лимфосистему и выводится из организма естественным путем, например через кожу при активном движении. Поэтому в помощь липолизу рекомендуется включить в курс миостимуляцию либо (или в комплексе с ней) физические нагрузки.
Гистохимические методы определения в тканях
Самым старым методом окрашивания Л. в тканях является метод с использованием четырехокиси осмия (OsO4). Этот реактив восстанавливается непредельными жирными к-тами и целым рядом других веществ, обладающих восстанавливающими свойствами. Продукты восстановления OsO4 окрашены в черный цвет. Однако следует признать, что методы выявления Л. с помощью жирорастворимых красителей более просты и надежны. В гистохимии для этих целей прежде всего стали использовать судан III, несколько позже — судан IV и шарлах. Л. более интенсивно окрашиваются красящими смесями, особенно теми, которые содержат два (или более) гомолога или изомера нафтоловых суданов. Окрашивание Л. жирорастворимыми красителями основано на том, что они растворяются в жировых веществах лучше, чем в обычных растворителях. Термин «суданофилия» означает способность ткани окрашиваться любыми жирорастворимыми красителями.
Для сохранения Л. в тканях при фиксации рекомендуется использовать 10 — 15% р-р формалина, но еще лучше использовать фиксатор формол-кальций по Бейкеру: формалин— 10 мл; 10% хлористый кальций — 10 мл; дистиллированная вода — 80 мл.
К этому фиксатору должен быть добавлен мел, для того чтобы смесь имела нейтральную реакцию. Фиксировать ткань рекомендуется 24—48 час., более длительная фиксация может привести к образованию кристаллов, изменению растворимости Л. и т. д. Отмытая после фиксации ткань промывается в проточной воде; срезы готовятся на замораживающем микротоме. Ткань паренхиматозных органов можно предварительно заключить в желатину.
При окрашивании ткани на Л. дает хорошие результаты и одновременно выявляет суданофильную зернистость в сегментоядерных лейкоцитах метод Гольдмана. Р-р судана III для окраски тканей по этому методу готовится следующим образом: 70% этанол — 100 мл; дистиллированная вода —- 20 мл; альфа-нафтол — 1,2 г; судан III — в избытке.
Смесь кипятят в течение 10 мин. и фильтруют. Срезы ткани красят 15 мин., затем дифференцируют в 70% этаноле, контролируя процесс под микроскопом. Мазки крови фиксируют 3 мин. смесью, состоящей из 1 части формалина и 4 частей 96 % этанола.
При окраске тканей на Л. по методу Чаччо следует маленькие кусочки фиксировать в течение 24—48 час. в смеси следующего состава: 5% водный р-р двухромовокислого калия — 80 мл; формалин — 20 мл; ледяная уксусная к-та — 5 мл.
Затем кусочки ткани выдерживают 5 — 8 дней в 3% двухромовокислом калии («хромируют»), сутки промывают в проточной воде, проводят через этанол восходящих концентраций в течение суток, проводят через ксилол и заключают в парафин. Приготовленные срезы после обработки 70% этанолом красят насыщенным р-ром судана III в 70% этаноле или при температуре 50° красителем следующего состава: 80 % этанол — 95 мл; ацетон — 5 мл; судан III — до насыщения.
После охлаждения жидкость фильтруется. Срезы красят 30 — 60 мин. при температуре 30°, споласкивают 50% этанолом, промывают в дистиллированной воде и заключают в глицерин-желатину.
Ядра клеток можно красить на Л. квасцовым гематоксилином, лучше это делать до обработки срезов су-даном. Л. окрашиваются в оранжевокрасный цвет.
Библиография: Алимова Е. К., Аствацатурьян А. Т. и Жаров Л. В. Липиды и жирные кислоты в норме и при ряде патологических состояний, М., 1975; Биохимические методы исследования в клинике, под ред. А. А. Покровского, М., 1969; Кейтс М. Техника липидологии, пер. с англ., М., 1975; Комаров Ф. И., Коровкин Б. Ф. и Меньшиков В. В. Биохимические исследования в клинике, Л., 1976; Липиды, под ред. С. Е. Северина, М., 1977; Меркулов Г. А. Курс патологогистологической техники, с. 241, Л., 1969; П и р с Э. Гистохимия, пер., с англ., с, 259, М., 19 62; Lipids, ed. by R. Paoletti а. о., v. 1—2, N. Y., 1976; Masoro E. J. Physiological chemistry of lipids in mammals, Philadelphia, 1968; Searcy R. L. Lipopa-thies, Springfield, 1971.
Ресинтез липидов в энтероцитах
Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, одновременно могут использоваться и эндогенные жирные кислоты, поэтому ресинтезированные жиры отличаются от пищевых и более близки по составу к «своим» жирам. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это, во-первых, ликвидирует их детергентное действие на мембраны и, во-вторых, создает их транспортные формы для переноса по крови в ткани.
Активация жирной кислоты
Поступившая в энтероцит (как и в любую другую клетку) жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
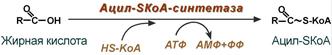
Реакция активации жирной кислоты
Ресинтез эфиров холестерола
Холестерол этерифицируется с использованием ацил-SКоА и фермента ацил-SКоА:холестерол-ацилтрансферазы (АХАТ).
Реэтерификация холестерола напрямую влияет на его всасывание в кровь. В настоящее время ищутся возможности подавления этой реакции для снижения концентрации ХС в крови.
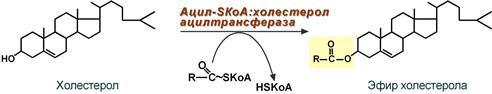
Реакция ресинтеза эфиров холестерола
Ресинтез триацилглицеролов
Для ресинтеза ТАГ есть два пути:
Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ.
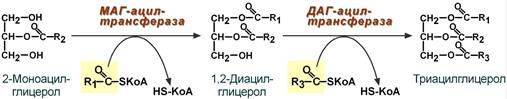
Моноацилглицеридный путь образования ТАГ
Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется, а глицерол в энтероцитах не задерживается и быстро переходит в кровь, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы. Здесь можно выделить следующие реакции:
- Образование глицерол-3-фосфата из глюкозы.
- Превращение глицерол-3-фосфата в фосфатидную кислоту.
- Превращение фосфатидной кислоты в 1,2-ДАГ.
- Синтез ТАГ.
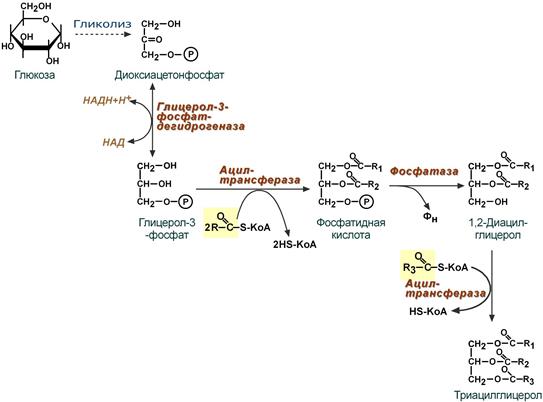
Глицеролфосфатный путь образования ТАГ
Ресинтез фосфолипидов
Фосфолипиды синтезируются также, как и в остальных клетках организма (см «»). Для этого есть два способа:
Первый путь – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина.
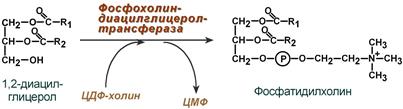
Ресинтез фосфолипидов из ДАГ на примере фосфатидилхолина
Второй путь – на основе синтезируемой in situ фосфатидной кислоты.
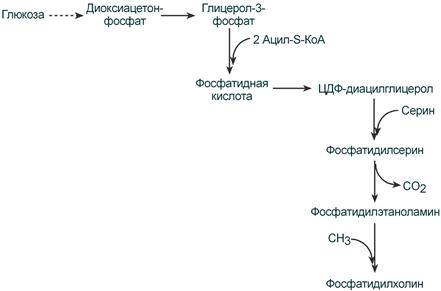
Схема ресинтеза фосфолипидов из фосфатидной кислоты
После ресинтеза фосфолипиды, триацилглицеролы, холестерол и его эфиры упаковываются в особые транспортные формы липидов – липопротеины и только в такой форме они способны покинуть энтероцит и транспортироваться в крови. В кишечнике формируются два вида липопротеинов – хиломикроны и липопротеины высокой плотности (ЛПВП), другие типы липопротеинов здесь не образуются.