Bacillus thuringiensis var. kurstaki
Содержание:
- Описание
- Что известно о причинах, вызывающих зубной кариес?
- Биологические свойства
- Состав
- Статья составлена с использованием следующих материалов:
- Безопасность
- Описание
- Способы передвижения
- Структура генома
- Действие на вредные организмы
- Диагностика
- Особенности лечения болезни
- Место обитания
- Филогения
- Бактериофаг
- Кожа под микроскопом
- Клинические аспекты
Описание
Bacillus subtilis — это грамположительные палочковидные и каталазоположительные бактерии . Первоначально он был назван Vibrio Сенного по христианскому Готфриду Эренбергу и переименован Сенная палочки по Фердинанду Кона в 1872 году (Сенных будучи латинским «штраф»). Клетки B. subtilis обычно имеют палочковидную форму, около 4–10 микрометров (мкм) в длину и 0,25–1,0 мкм в диаметре, с объемом клеток около 4,6 мкл в стационарной фазе. Как и другие представители рода Bacillus , он может образовывать эндоспоры , чтобы выжить в экстремальных условиях окружающей среды с температурой и высыханием. B. subtilis является факультативным анаэробом и считался облигатным аэробом до 1998 года. B. subtilis сильно жгутиконосит , что дает ему способность быстро перемещаться в жидкостях.
B. subtilis оказался в высшей степени поддающимся генетическим манипуляциям и получил широкое распространение в качестве модельного организма для лабораторных исследований, особенно споруляции , которая является упрощенным примером клеточной дифференциации . С точки зрения популярности в качестве лабораторной модели организма B. subtilis часто рассматривается как грамположительный эквивалент Escherichia coli , широко изученной грамотрицательной бактерии.
Что известно о причинах, вызывающих зубной кариес?
О существовании кариеса люди знают уже много столетий. Все это время его изучали, пытались понять причину и найти наиболее эффективный метод лечения. И хотя существует множество работ, посвященных теориям возникновения и развития кариеса, это заболевание до сих пор не изучено до конца. Для современной концепции характерно выделение четырех главных факторов, которые, действуя одновременно, вызывают кариес. К ним относятся микробный зубной налет, состояние зубной эмали, употребление углеводной пищи и время.

В этой статье
Считается, что на первой стадии вызывает кариес углеводная пища, которая формирует благоприятную среду для размножений бактерий и нарушает нормальную микрофлору ротовой полости.В результате большого количества сахаров и углеводов в зубном налете нарушается так называемый микробный гомеостаз — то есть относительное постоянство количества и состава микроорганизмов в ротовой полости.
Биологические свойства
Клетки B. cereus, окраска жгутиков по Лейфсону
Бациллы являются аэробами или факультативными анаэробами, большинство представителей хемоорганогетеротрофы и растёт на простых питательных средах. Некоторые виды способны к нитратредукции. Крупные и среднего размера прямые или слабо изогнутые палочки, способные к образованию устойчивых к неблагоприятным воздействиям эндоспор (экстремальным температурам, высушиванию, ионизирующим излучениям, химическим агентам), большинство видов подвижно и обладают жгутиками расположенными перитрихиально, Bacillus anthracis образует капсулы. По методу Грама окрашиваются положительно. Недавние исследования выявили, что бактерии вида Bacillus subtilis способны к каннибализму во время споруляции путём продукции токсинов в окружающую среду и дальнейшему лизису клеток своего вида.
Состав
Клеточная стенка
Bacillus subtilis ( окраска по Граму )
Клеточная стенка Bacillus — это структура снаружи клетки, которая образует второй барьер между бактерией и окружающей средой, и в то же время сохраняет форму стержня и выдерживает давление, создаваемое тургором клетки . Клеточная стенка состоит из тейхоевой и тейхуроновой кислот. B. subtilis — первая бактерия, для которой была идентифицирована роль актин- подобного цитоскелета в определении формы клеток и синтезе пептидогликана и для которой был локализован весь набор ферментов, синтезирующих пептидогликаны. Роль цитоскелета в формировании и поддержании формы важна.
Виды Bacillus представляют собой палочковидные, образующие эндоспоры аэробные или факультативно анаэробные грамположительные бактерии; у некоторых видов культуры с возрастом могут стать грамотрицательными. Многие виды этого рода демонстрируют широкий спектр физиологических способностей, которые позволяют им жить в любой естественной среде. На клетку образуется только одна эндоспора. Споры устойчивы к жаре, холоду, радиации, сушке и дезинфицирующим средствам.
Статья составлена с использованием следующих материалов:
Березина Н.В. Биологические препараты «Алирин-Б» и «Гамаир» в борьбе с фитофторозом томата и картофеля. Биологические препараты. Сельское хозяйство. Экология / ООО «ЭМ-Кооперация». — Москва, 2008. — С. 246-248
2.
Березина Н.В.; Костенко Т.А. Механизмы действия микробиологических препаратов «Алирин-Б» и «Гамаир» . Биологические препараты. Сельское хозяйство. Экология / ООО «ЭМ-Кооперация». — Москва, 2008. — с. 248-250
3.
Биологическая защита растений/М. В. Штерншис, Ф. С.-У. Джалилов, И. В. Андреева, О. Г. Томилова; Под ред. М. В. Штерншис. — М.: КолосС, 2004. — л. ил.: ил. — 264 с. — (Учебники и учеб. пособия для студентов высш. учеб. заведений);
4.
Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации, 2013 год. Министерство сельского хозяйства Российской Федерации (Минсельхоз России)
5.
Гришечкина Л.Д., Долженко В.И. и др. Бактериальные препараты в борьбе с болезнями сельско-хозяйственных культур. Материалы международной научно-практической конференции «Современные средства, методы и технологии защиты растений»/ сибирский научно-исследовательский институт земледелия и химизации сельского хозяйства. – Новосибирск, 2008. — с. 48-52
6.
Иванова Г.П., Красавина Л.П. Влияние бактофита на комплекс энтомофагов, применяемых в защищенном грунте. Материалы VIсовещания «Вид и его продуктивность в ареале», Санкт-Петербург, 23-26 ноября 1993 г. Санкт-Петербург, Гидрометеоиздат, 1993. с.237-238
7.
Коробова Л.Н., Холдобина Т.В. и др. Влияние гербицидов и биологических антидепрессантов к ним на микрофлору и фитотоксичность почвы в последействии
8.
Краткий словарь-справочник по биологической защите растений, Российская академия сельско-хозяйственных наук . Санкт-Петербург, 2005, — 99 с.
9.
Помелов А.В, Влияние биопрепаратов Альбит и Алирин-Б на корневые гнили и урожайность ячменя. Материалы всероссийской научно-практической конференции «Инновационное развитие АПК. Итоги и перспективы» 06.02.-09.02.2007 г. Т.1/ Ижевская государственная сельскохозяйственная академия. – Ижевск, 2007. – с.26-29
10.
Рудаков В., Морозов Д. Защитим урожай фитопрепаратами. Журнал «Главный агроном», 11, 2008 г., с.27-29
11.
Сахибгареев А.А.; Лукьянов С.А.; Мухутдинов Ф.Г.; Кудоярова Р.А. Фитоспорин-М — модифицированный промышленный микробиологический фунгицид комплексного действия . Эффективность гербицидов и фунгицидов при совместном применении с антистрессовыми регуляторами роста на зерн.культурах. – Уфа: Гилем, 2003. — с. 65-70
12.
Хаитов Р.М. Аллергология и иммунология. Национальное руководство. М.: ГЭОТАР-Медиа, 2009. – 636 с.
Изображения (переработаны):
13.
B0008259 Confocal micrograph of Bacillus subtilis, by Wellcome Images, по лицензии CC BY-NC-ND
14.
Bacillus subtilis, Bacillus subtilis, Maciej Górny, by Davehwng, по лицензии CC BY-NC-SA
15.
DSC00013, by Oliver Tan Mejia, по лицензии CC BY-ND
Свернуть
Список всех источников
Безопасность
У других животных
B. subtilis был рассмотрен Центром ветеринарной медицины FDA США и обнаружил, что не представляет проблем с безопасностью при использовании в микробных продуктах прямого кормления, поэтому Ассоциация американских должностных лиц по контролю кормов внесла его в список одобренных для использования в качестве ингредиента кормов для животных в разделе 36.14 «Микроорганизмы прямого кормления». Канадское агентство по инспекции пищевых продуктов Раздел здоровья животных и кормопроизводство классифицировал Bacillus культуры обезвоженных одобрил кормовые ингредиенты в качестве силосной добавки под Schedule IV-Часть 2-Class 8.6 и присвоен международный поток Ингредиент количество IFN 8-19-119. С другой стороны, несколько кормовых добавок, содержащих жизнеспособные споры B. subtilis , были положительно оценены Европейским органом по безопасности пищевых продуктов в отношении их безопасного использования для набора веса в животноводстве.
В людях
Споры B. subtilis могут пережить сильную жару во время приготовления. Некоторые штаммы B. subtilis вызывают вязкость или порчу веревки — липкую, вязкую консистенцию, вызванную бактериальным образованием длинноцепочечных полисахаридов — в испорченном хлебном тесте и хлебобулочных изделиях. Долгое время, по данным биохимических тестов , вязкость хлеба была однозначно связана с видами B. subtilis . Молекулярные анализы (анализ ПЦР с произвольной амплификацией полиморфной ДНК, анализ денатурирующего градиентного гель-электрофореза и секвенирование области V3 рибосомальной ДНК 16S) выявили большее разнообразие видов Bacillus в хлопьях из хлопьевидного хлеба, которые, по-видимому, обладают положительной активностью амилазы и высокой термостойкостью. B. subtilis CU1 (2 × 10 9 спор в день) оценивали в 16-недельном исследовании (10-дневное введение пробиотика с последующим 18-дневным периодом вымывания каждый месяц; повторение той же процедуры в течение всего 4 месяцев) на здоровых предметы. Было обнаружено, что B. subtilis CU1 безопасен и хорошо переносится субъектами без каких-либо побочных эффектов.
B. subtilis и производные от него вещества были оценены различными авторитетными органами на предмет их безопасного и полезного использования в пищевых продуктах. В Соединенных Штатах в письме-заключении, выпущенном в начале 1960-х годов Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), некоторые вещества, полученные из микроорганизмов, были признаны общепризнанными безопасными (GRAS), включая ферменты карбогидразы и протеазы из B. subtilis . Мнения основывались на использовании непатогенных и нетоксикогенных штаммов соответствующих организмов и на использовании современной надлежащей производственной практики. FDA заявило, что ферменты, полученные из штамма B. subtilis, широко использовались в пищевых продуктах до 1 января 1958 года, и что нетоксигенные и непатогенные штаммы B. subtilis широко доступны и безопасно использовались в различных пищевых продуктах. Это включает потребление японских ферментированных соевых бобов в форме натто , которые обычно потребляются в Японии и содержат до 10 8 жизнеспособных клеток на грамм. Ферментированные бобы известны своим вкладом в здоровую кишечную флору и потребление витамина K 2 ; В течение этой долгой истории широкого применения натто не участвовал в побочных эффектах, потенциально связанных с присутствием B. subtilis . Продукт натто и B. subtilis natto в качестве его основного компонента — это продукты FOSHU (продукты, предназначенные для использования в медицинских целях), одобренные Министерством здравоохранения, труда и социального обеспечения Японии как эффективные для сохранения здоровья.
B. subtilis получил статус «Квалифицированная презумпция безопасности» Европейским управлением по безопасности пищевых продуктов .
Описание
CD14 и Mac-1 работают вместе, увеличивая интернализацию макрофагами спор B. anthracis . (а) CD14 и TLR2 работают в непосредственной близости для распространения сигнала активации. Mac-1 начинается с закрытого подтверждения, которое не позволяет интегрину связывать споры, не давая им попасть в клетку. (b) CD14 связывает остатки рамнозы на BclA экзоспория, что приводит к TLR2-опосредованной активации PI3K. (c) Активация PI3K подталкивает Mac-1 к его открытой конформации, так что спора может быть связана и интернализована (информация от Oliva et al. 2009)
B. anthracis представляют собой палочковидные бактерии длиной примерно от 3 до 5 мкм и шириной от 1 до 1,2 мкм. При выращивании в культуре они, как правило, образуют длинные цепочки бактерий. На чашках с агаром они образуют большие колонии в несколько миллиметров в диаметре, обычно белого или кремового цвета. Большинство штаммов B. anthracis образуют капсулу, которая придает колониям вид слизистой слизи.
Это одна из немногих бактерий, которые, как известно, синтезируют слабоиммуногенные и антифагоцитарные белковые капсулы (поли-D-гамма-глутаминовая кислота), которые скрывают вегетативные бактерии от иммунной системы хозяина. Большинство бактерий окружено полисахаридной капсулой, а не поли-gD-глутаминовой кислотой, что обеспечивает эволюционное преимущество B. anthracis . Полисахариды связаны с адгезией дефенсинов , секретируемых нейтрофилами, которые неактивны и разрушают бактерии. Не удерживая эту макромолекулу в капсуле, B. anthracis может избежать нейтрофильной атаки и продолжить распространение инфекции. Разница в составе капсул также значительна, потому что была выдвинута гипотеза, что поли-gD-глутаминовая кислота создает отрицательный заряд, который защищает вегетативную фазу бактерий от фагоцитоза макрофагами . Капсула разлагается до более низкой молекулярной массы и высвобождается с поверхности бактериальной клетки, чтобы действовать как приманка для защиты бактерий от .
Как и Bordetella pertussis , он вместе с летальным фактором сибирской язвы образует кальмодулин- зависимый экзотоксин аденилатциклазы, известный как фактор отека сибирской язвы . Он имеет близкое генотипическое и фенотипическое сходство с Bacillus cereus и Bacillus thuringiensis . Все три вида имеют общие клеточные размеры и морфологию . Все образуют овальные споры, расположенные в центре не набухшего спорангия . В частности, эндоспоры B. anthracis обладают высокой устойчивостью, выдерживают экстремальные температуры, среду с низким содержанием питательных веществ и жесткую химическую обработку в течение десятилетий или столетий.
Эндоспора — это обезвоженная клетка с толстыми стенками и дополнительными слоями, которые образуются внутри клеточной мембраны. Он может оставаться бездействующим в течение многих лет, но если попадает в благоприятную среду, он снова начинает расти. Изначально он развивается внутри стержневой формы. Такие особенности, как расположение внутри стержня, размер и форма эндоспоры, а также то, вызывает ли это выпячивание стенки стержня или нет, характерны для определенных видов Bacillus . В зависимости от вида эндоспоры бывают круглыми, овальными или иногда цилиндрическими. Они обладают высокой рефракцией и содержат дипиколиновую кислоту . Электронно-микроскопические снимки показывают, что они имеют тонкую внешнюю оболочку эндоспор, толстую кору спор и внутреннюю мембрану спор, окружающую содержимое эндоспор. Эндоспоры устойчивы к нагреванию, сушке и многим дезинфицирующим средствам (включая 95% этанол). Благодаря этим свойствам эндоспоры B. anthracis чрезвычайно хорошо подходят для использования (в порошкообразной и аэрозольной форме) в качестве биологического оружия . Такое размещение оружия осуществлялось в прошлом по крайней мере пятью государственными программами создания биологического оружия — в Соединенном Королевстве , Японии , США , России и Ираке — и было предпринято несколькими другими.
Способы передвижения
Среди бактерий есть подвижные и неподвижные формы. Подвижные передвигаются за счёт волнообразных сокращений или при помощи жгутиков (скрученные винтообразные нити), которые состоят из особого белка флагеллина. Жгутиков может быть один или несколько. Располагаются они у одних бактерий на одном конце клетки, у других – на двух или по всей поверхности.
Но движение присуще и многим иным бактериям, у которых жгутики отсутствуют. Так, бактерии, покрытые снаружи слизью, способны к скользящему движению.
У некоторых лишённых жгутиков водных и почвенных бактерий в цитоплазме имеются газовые вакуоли. В клетке может быть 40-60 вакуолей. Каждая из них заполнена газом (предположительно – азотом). Регулируя количество газа в вакуолях, водные бактерии могут погружаться в толщу воды или подниматься на её поверхность, а почвенные бактерии – передвигаться в капиллярах почвы.
Структура генома
B. anthracis имеет единственную хромосому, которая представляет собой кольцевую молекулу ДНК длиной 5 227 293 п.н. Он также имеет две кольцевые, внехромосомные, двухцепочечные плазмиды ДНК, pXO1 и pXO2. Обе плазмиды pXO1 и pXO2 необходимы для полной вирулентности и представляют два различных семейства плазмид.
| Характерная черта | Хромосома | pXO1 | pXO2 |
|---|---|---|---|
| Размер (пп) | 5 227 293 | 181 677 | 94 829 |
| Количество генов | 5 508 | 217 | 113 |
| Кодирование репликона (%) | 84,3 | 77,1 | 76,2 |
| Средняя длина гена (н. | 800 | 645 | 639 |
| Содержание G + C (%) | 35,4 | 32,5 | 33,0 |
| рРНК опероны | 11 | ||
| тРНК | 95 | ||
| мРНК | 3 | 2 | |
| Гены фага | 62 | ||
| Гены транспозонов | 18 | 15 | 6 |
| Нарушение рамки считывания | 37 | 5 | 7 |
| Гены с назначенной функцией | 2 762 | 65 | 38 |
| Консервированные гипотетические гены | 1,212 | 22 | 19 |
| Гены неизвестной функции | 657 | 8 | 5 |
| Гипотетические гены | 877 | 122 | 51 |
плазмида pXO1
Плазмида pXO1 (182 kb) содержит гены, кодирующие компоненты токсина сибирской язвы : pag (защитный антиген, PA), lef (летальный фактор, LF) и cya (фактор отека, EF). Эти факторы находятся в пределах острова патогенности (PAI) размером 44,8 т.п.н. Смертельный токсин представляет собой комбинацию PA с LF, а токсин отека представляет собой комбинацию PA с EF. PAI также содержит гены, которые кодируют активатор транскрипции AtxA и репрессор PagR, оба из которых регулируют экспрессию генов токсина сибирской язвы.
плазмида pXO2
pXO2 кодирует оперон из пяти генов ( capBCADE ), который синтезирует капсулу поли-γ-D-глутаминовой кислоты (полиглутамата). Эта капсула позволяет B. anthracis уклоняться от иммунной системы хозяина, защищаясь от фагоцитоза . Экспрессия капсульного оперона активируется регуляторами транскрипции AcpA и AcpB, расположенными на острове патогенности pXO2 (35 т.п.н.). Экспрессия AcpA и AcpB находится под контролем AtxA из pXO1.
Действие на вредные организмы
Препараты на основе Bacillus thuringiensis, var. kurstaki обладают кишечным действием, эффективность которого проявляется только при попадании в кишечник насекомого при его активном питании. Специфичность действия на гусениц чешуекрылых связана со своеобразием их пищеварительной системы, которая имеет комбинацию рН, содержание солей и ферментов, необходимую для разложения и активации токсина бактерии.
Механизм действия. Активированный в кишечном тракте токсин вызывает повреждение внутренней оболочки кишечника гусеницы, в результате чего нарушается осмотическое равновесие, приводящее к просачиванию щелочного содержимого кишечника в тело гусеницы. Это просачивание может привести к гибели насекомого или вызвать у него такие изменения, которые создают условия для развития спор, содержащихся в препарате, или развитие постоянно присутствующей в насекомом кишечной микрофлоры, в результате чего проявляется септицемия.
Гибель гусеницы в зависимости от дозы препарата может наступать не сразу (1-4 дня), однако повреждения, нанесенные кишечному тракту, нарушают способность гусеницы переваривать пищу и вызывают приостановку питания и тем самым снижается поврежденность защищаемой культуры.
Наиболее высокая эффективность проявляется против открыто питающихся личинок младших возрастов при температуре воздуха 18-30°С. Массовая гибель насекомых наступает на 2-5-е сутки. У препаратов на основе Bacillus thuringiensis, var. kurstaki наблюдается воздействие и на последующие поколения насекомых – вредителей растений: в популяциях появляются уродливые куколки, а появившиеся из них бабочки дают неспособное к продлению рода потомство, меняется также соотношение полов, снижается плодовитость самок. Препараты на основе Bacillus thuringiensis, var. kurstaki сохраняют свою активность на обработанных растений в течение 8-10 дней.
Диагностика
В случае болезни пищевого происхождения диагноз B. cereus может быть подтвержден путем выделения более 100000 организмов B. cereus на грамм из продуктов питания, связанных с эпидемиологическими факторами, но такое тестирование часто не проводится, поскольку болезнь относительно безвредна и обычно сама себя -ограничение.
Идентификация
Для выделения и подсчета Б. сегеиз , есть два стандартных методов по Международной организации по стандартизации (ISO): ISO 7931 и ISO 21871. Из — за Б. сегеиз » способность производить Лецитиназа и его неспособность к ферментной маннит , есть некоторые подходящие селективные среды для его выделения и идентификации, такие как маннит-яичный желток-полимиксин (MYP) и агар полимиксин-пируват-яичный желток-маннит-бромтимоловый синий агар (PEMBA). Колонии B. cereus на MYP имеют фиолетово-красный фон и окружены зоной осадка яичного желтка.
Ниже приведен список дифференциальных методов и результатов, которые могут помочь отличить B. cereus от других бактерий и видов Bacillus .
- Анаэробный рост : положительный
- Тест Фогеса-Проскауэра : положительный
- Кислота производится из
- D- глюкоза: положительный
- L -арабиноза: отрицательный
- D- ксилоза: отрицательный
- D -маннитол: отрицательный
- Гидролиз крахмала : положительный
- Снижение нитратов : положительное
- Распад тирозина : положительный
- Рост на
- Использование цитрата : положительно
Центральная лаборатория общественного здравоохранения Соединенного Королевства проверяет подвижность, гемолиз, рост ризоидов, восприимчивость к γ-фагу и ферментацию глюкозы на основе соли аммония, но без маннита, арабинозы или ксилозы.
Особенности лечения болезни
Назначение лечения коккобациллярной флоры невозможно без определения причин, спровоцировавших её развитие. Как уже было отмечено, нередко повышение уровня кокков и бацилл выступает признаком развития дисбактериоза в организме. Коррекция состояния в данном случае может быть достигнута изменениями ежедневного рациона.
Так, питание рекомендуется разнообразить кисломолочными продуктами и приёмами витаминных комплексов. Если же диагностирована тяжелая форма дисбактериоза, может понадобиться лечение пробиотиками, предназначенными для быстрого восстановления природной микрофлоры.
Выявление патологического нарушения может свидетельствовать и о наличии инфекционных заболеваний, передающихся половым путем. Пациенткам с таким диагнозом, как правило, назначают лечение противомикробными лекарственными средствами, антибиотиками и иммуномодуляторами, необходимыми для восстановления ослабленной иммунной системы.
Лечение диагностированных заболеваний, передающихся половым путем, предполагает прохождение назначенной терапии обеими партнерами. Лечение требуется даже в тех случаях, если пациента ничего не беспокоит. Дело в том, что даже без ярко выраженной симптоматики ЗППП могут стать причиной бесплодия и не менее серьёзных осложнений.
Специалисты в назначении схемы подавления коккобациллярной флоры отдают предпочтение комплексному подходу, предполагающему одновременное применение таблетированных препаратов с лекарственными средствами местного использования.
В большинстве случаев пациентам назначают лечение Метронидазолом – препаратом, противодействующим простейшим микроорганизмам и анаэробной флоре. Не меньшую эффективность приписывают и Орнидазолу, и Тенонитрозолу.
Что касается препаратов местного применения, то наиболее популярным в данной категории считается Гиналкин – таблетированное лекарственное средство, отличающееся широким спектром воздействия и предназначенное для введения во влагалище. Согласно многочисленным отзывам, нормализация состояния наблюдается после прохождения двухнедельного курса лечения.
Место обитания
В силу простоты организации и неприхотливости бактерии широко распространены в природе. Бактерии обнаружены везде: в капле даже самой чистой родниковой воды, в крупинках почвы, в воздухе, на скалах, в полярных снегах, песках пустынь, на дне океана, в добытой с огромной глубины нефти и даже в воде горячих источников с температурой около 80ºС. Обитают они на растениях, плодах, у различных животных и у человека в кишечнике, ротовой полости, на конечностях, на поверхности тела.
Бактерии – самые мелкие и самые многочисленные живые существа. Благодаря малым размерам они легко проникают в любые трещины, щели, поры. Очень выносливы и приспособлены к различным условиям существования. Переносят высушивание, сильные холода, нагревание до 90ºС, не теряя при этом жизнеспособность.
Практически нет места на Земле, где не встречались бы бактерии, но в разных количествах. Условия жизни бактерий разнообразны. Одним из них необходим кислород воздуха, другие в нём не нуждаются и способны жить в бескислородной среде.
В воздухе: бактерии поднимаются в верхние слои атмосферы до 30 км. и больше.
Особенно много их в почве. В 1 г. почвы могут содержаться сотни миллионов бактерий.
В воде: в поверхностных слоях воды открытых водоёмов. Полезные водные бактерии минерализуют органические остатки.
В живых организмах: болезнетворные бактерии попадают в организм из внешней среды, но лишь в благоприятных условиях вызываю заболевания. Симбиотические живут в органах пищеварения, помогая расщеплять и усваивать пищу, синтезируют витамины.
Филогения
Были представлены три предложения, представляющих филогению рода Bacillus . Первое предложение, представленное в 2003 году, представляет собой исследование специфических для Bacillus , с наибольшим разнообразием, охватываемым с использованием 16S и ITS регионов. Он делит род на 10 групп. Сюда входят вложенные роды Paenibacillus , Brevibacillus , Geobacillus , Marinibacillus и Virgibacillus .
Второе предложение, представленное в 2008 году, построило дерево 16S (и 23S, если доступно) всех утвержденных видов. Род Bacillus содержит очень большое количество вложенных таксонов, в основном как 16S, так и 23S. Он парафилетичен для Lactobacillales ( Lactobacillus, Streptococcus, Staphylococcus, Listeria и т. Д.) Из-за Bacillus coahuilensis и других.
Третье предложение, представленное в 2010 году, представляло собой исследование конкатенации генов , и оно показало результаты, аналогичные предложению 2008 года, но с гораздо более ограниченным числом видов с точки зрения групп. (В этой схеме Listeria использовалась как внешняя группа, поэтому в свете дерева ARB она может быть «наизнанку»).
Одна клада, образованная Bacillus anthracis , Bacillus cereus , Bacillus mycoides , Bacillus pseudomycoides , Bacillus thuringiensis и Bacillus weihenstephanensis в соответствии со стандартами классификации 2011 г., должна быть одним видом (в пределах 97% идентичности 16S), но по медицинским причинам они считаются отдельными видами (проблема также существует для четырех видов Shigella и Escherichia coli ).
|
Филогенетика Bacillus |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Филогения рода Bacillus по |
Бактериофаг
Бактерии группы B. cereus инфицированы бактериофагами, принадлежащими к семейству Tectiviridae . Это семейство включает бесхвостые фаги, которые имеют липидную мембрану или везикулу под икосаэдрической белковой оболочкой и образованы примерно из равных количеств кодируемых вирусом белков и липидов, полученных из плазматической мембраны клетки-хозяина . После инфицирования липидная мембрана становится хвостовидной структурой, используемой для доставки генома. Геном состоит из 15- килобазной линейной двухцепочечной ДНК (дцДНК) с длинными инвертированными последовательностями концевых повторов (100 пар оснований). GIL01 , Bam35 , GIL16 , AP50 и Wip1 являются примерами теквирусов умеренного климата, инфицирующих группу B. cereus .
Кожа под микроскопом
По данным американских микробиологов (Grice 2011), на коже находится 1,8 м2 разнообразных мест обитания микроорганизмов, включая бактерии, грибы, вирусы, клещи.
Микрофлора делится на постоянную – резидентную (около 90 % микробов), факультативную (условно-патогенную) – около 9,5 % и случайную (транзиторную) – 0,5 %.
Согласно доктору медицинских наук Виктору Бондаренко, заведующему лабораторией генетики вирулентности бактерий Института эпидемиологии и микробиологии им. Н. Ф. Гамалеи РАМН, около 20 % микроорганизмов от общего числа обитает в полости рта (более 200 видов), 18–20 % приходится на кожные покровы, 15–16 % — на глотку, 2–4 % – на урогенитальный тракт у мужчин и примерно 10 % – на вагинальный биотоп у женщин, а больше всего микроорганизмов (до 40 %) – в желудочно-кишечном тракте (Бондаренко 2007).
Микробиом кожи определяется такими факторами, как pH, температура, влажность, уровень выработки кожного сала, окислительный стресс, диета, инфекции. Кожа обладает высокой обновляемостью клеток, поскольку она постоянно противостоит воздействию внешних факторов.
Микробиом кожи меняется от человека к человеку. Уникальный профиль микробиоты человека задается в зависимости от «экониши», на него также влияет количество света и влажности/сухости, число волосяных фолликулов, пол и возраст (Krajewska-Włodarczyk 2017).
Некоторые распространенные полезные и патогенные бактерии приведены в таблице ниже, а также в ранее опубликованных на портале статьях.
Таблица 1. Кожный микробиом
|
Нормальная микрофлора |
Патогенная микрофлора |
|
Streptococcus viridans (стрептококк зеленящий) – нормальные обитатели полости рта, глотки, носа. |
Staphylococcus aureus (золотистый стафилококк) |
|
Staphylococcus saprophyticus (стафилококк сапрофитный) – самый мирный из стафилококков, основное его место обитания – это стенка мочевого пузыря и кожа вблизи гениталий, поэтому нетрудно догадаться, что он является возбудителем цистита, которому больше подвержены женщины. |
Streptococcus pyogenes (стрептококк пиогенный, он же бета-гемолитический стрептококк группы А) – дает осложнения в виде ревматизма, поражая почки, сосуды мозга, сердце, суставы. |
|
Staphylococcus epidermidis (стафилококк эпидермальный) – обитает в различных областях слизистых и кожных покровов. Эпидермис – поверхностный слой кожи, отсюда и название. |
Streptococcus pneumoniae (пневмококк) – возбудитель пневмонии и менингита. |
|
Staphylococcus haemolyticus (стафилококк гемолитический) |
Pseudomonas aeruginosa (синегнойная палочка) |
|
Грибы рода Candida |
Klebsiella pneumoniae, ozaenae, rhinoscleromatis (клебсиеллы пневмонии, озены, риносклеромы) |
|
Непатогенные виды бацилл, коринебактерии и др. |
Yersinia enterocolitica, pseudotuberculosis (иерсинии энтероколита и превдотуберкулеза) |
Известно, что сухие участки кожи на предплечьях, ягодицах и кистях активно заселены бактериями вида Actinobacteria, Proteobacteria, Firmicutes и Bacteriodetes. Удивительной особенностью микробиоты этих зон является обилие граммотрицательных организмов. Когда-то считалось, что они колонизируют кожу редко. Интересно, что на этих участках разнообразие бактерий больше, чем в кишечнике или полости рта одного и того же человека. Кроме того, микроорганизмы «привязаны» к текущему участку тела. И, пересаженные из одной среды обитания в другую, например, с языка на лоб, не способны колонизировать новую территорию или изменить существующее в этой области микробное сообщество (Costello et al. 2009).
Как этому невидимому и густонаселенному миру удается относительно спокойно и мирно существовать друг с другом на таком ограниченном участке, как наша кожа?
Ответ кроется в гомеостазе.
Клинические аспекты
Патогенез
B. anthracis обладает антифагоцитарной капсулой, необходимой для полной вирулентности. Организм также производит три экзотоксина, кодируемых плазмидой: фактор отека, кальмодулин-зависимая аденилатциклаза, которая вызывает повышение внутриклеточного цАМФ и ответственна за тяжелый отек, обычно наблюдаемый при инфекциях B. anthracis , летальный токсин, который вызывает некроз тканей, и защитный антиген, названный так из-за его использования в производстве защитных вакцин против сибирской язвы, который опосредует проникновение в клетки фактора отека и летального токсина.
Проявления при заболеваниях человека
Симптомы сибирской язвы зависят от типа инфекции и могут появиться в течение от 1 дня до более 2 месяцев. Все виды сибирской язвы, если их не лечить, могут распространяться по организму и вызывать тяжелые заболевания и даже смерть.
Четыре формы болезни человека сибирской язвой распознаются на основе их входного портала .
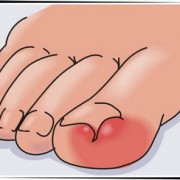
- Кожная, наиболее распространенная форма (95%), вызывает локализованные воспалительные черные некротические поражения ( струп ). Чаще всего язва появляется на лице, шее, руках или кистях. Развитие может произойти в течение 1–7 дней после заражения.
- Вдыхание — редкая, но очень смертельная форма, характеризующаяся гриппоподобными симптомами, дискомфортом в груди, потоотделением и болями в теле. Развитие обычно происходит через неделю после заражения, но может занять до двух месяцев.
- Желудочно-кишечный тракт, редкий, но также смертельный (вызывает смерть 25%) тип, возникает в результате проглатывания спор. Симптомы включают: лихорадку и озноб, отек шеи, болезненное глотание, охриплость голоса, тошноту и рвоту (особенно кровавую рвоту), диарею, покраснение и покраснение глаз, а также вздутие живота. Симптомы могут развиться в течение 1–7 дней.
- Симптомы инъекции аналогичны симптомам кожной сибирской язвы, но инъекционная сибирская язва может распространяться по телу быстрее, и ее труднее распознать и лечить по сравнению с кожной сибирской язвой. Симптомы включают лихорадку, озноб, группу небольших шишек или волдырей, которые могут зудеть и появляются в месте инъекции препарата. Безболезненная язва с черным центром, появляющаяся после волдырей или шишек. Отек вокруг язвы. Абсцессы глубоко под кожей или в мышце, куда вводили препарат. Этот тип записи никогда не был найден в США.
Профилактика и лечение
Ряд вакцин против сибирской язвы был разработан для профилактического использования у домашнего скота и людей. Адсорбированная вакцина против сибирской язвы (АВА) может защитить от кожной и ингаляционной сибирской язвы. Однако эта вакцина используется только для взрослых из группы риска до контакта с сибирской язвой и не была одобрена для использования после контакта. Инфекции, вызванные B. anthracis, можно лечить с помощью β-лактамных антибиотиков, таких как пенициллин , и других, которые активны против грамположительных бактерий. Резистентные к пенициллину B. anthracis можно лечить фторхинолонами, такими как ципрофлоксацин, или антибиотиками тетрациклинового ряда, такими как доксициклин .