Кроветворение
Содержание:
- Патологическая анатомия
- Назначение схемы гемопоэза
- Постэмбриональный гемопоэз
- Стволовые клетки
- Регуляция кроветворения
- Типы гематопоэза
- Механизмы регуляции
- Что будет, если гемопоэз нарушится
- Что представляет собой процесс кроветворения и где он происходит
- Лечение апластической анемии
- Наши врачи
- Депо крови
- Физиологические основы
- Контроль гемоцитопоэза
- Апластическая анемия: симптомы
Патологическая анатомия
Патоморфол, изменения в органах и тканях при Ж. а. зависят от основного заболевания, обусловившего истинный дефицит железа, или от инфекционных, токсических, бластоматозных процессов, ведущих к перераспределительному дефициту железа. Непосредственно с дефицитом железа связаны следующие изменения.
Гистол, исследование костного мозга методом трепанобиопсии (см.) обнаруживает нормальное строение или умеренную гиперплазию с уменьшением содержания жировой ткани в отличие от гипо- и апластических анемий (см. Гипопластическая анемия). При окраске по Перльсу не обнаруживается гранул гемосидерина, что указывает на опустошенность запасов железа. При длительном течении Ж. а. гиперплазия красного ростка сочетается с нарушением созревания клеток эритроидного ряда — преобладают базофильные эритробласты и микрогенерации нормобластов. Нарушения гемоглобинизации (феррипривные эритробласты) и дистрофические изменения эритропоэза являются следствием клеточного дефицита железа.
Изменения в других органах связаны с нарушением ферментативных процессов и длительной анемической гипоксией. Характерны атрофические процессы в жел.-киш. тракте, особенно атрофический гастрит. Наряду с атрофическим гастритом описаны изменения ротовой полости (глоссит, хейлит, гингивит, гиперкератоз и вакуолизация клеток эпителия слизистой оболочки щек, поражение зубов вследствие нарушения обмена эмали), поражения слизистой оболочки пищевода, лежащие в основе сидеропенической дисфагии и подтвержденные аспирационной биопсией.
В результате снижения содержания железа, уменьшения миоглобина и падения активности железосодержащих ферментов тканевого дыхания при Ж. а. вслед за приспособительными функциональными изменениями сердечно-сосудистой системы может развиться истинная дистрофия миокарда.
Длительная анемическая гипоксия ведет к жировой инфильтрации печени и других органов.
Назначение схемы гемопоэза
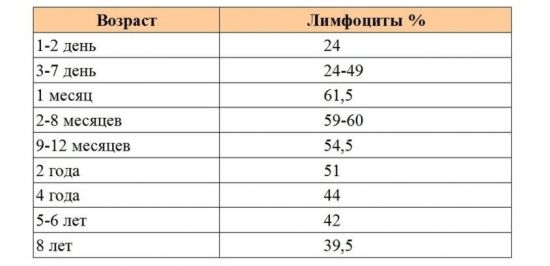
Схема гемопоэза
Все выше сказанное можно объединить в единую схему.
Назначение такой схемы трудно переоценить. Она имеет огромное количество плюсов и несомненную значимость.
- При помощи такой схемы можно отчетливо отследить все этапы образования интересующей клетки.
- Если нужная клетка не образовалась, можно отследить на каком этапе произошла ошибка и цепочка действий прервалась.
- Найдя ошибку в системе, врач может воздействовать на интересующее звено кроветворения, чтобы его простимулировать.
Таким образом, схема гемопоэза ясно представляет структуру периферической крови по компонентам, что также немаловажно в диагностике патологических процессов
Постэмбриональный гемопоэз
Постэмбриональный гемопоэз представляет собой процесс физиологической регенерации крови, который компенсирует физиологическое разрушение дифференцированных клеток. Он подразделяется на миелопоэз и лимфопоэз.
Миелопоэз происходит в миелоидной ткани, расположенной в эпифизах трубчатых и полостях многих губчатых костей. Здесь развиваются эритроциты, гранулоциты, моноциты, тромбоциты, а также предшественники лимфоцитов. В миелоидной ткани находятся стволовые клетки крови и соединительной ткани. Предшественники лимфоцитов постепенно мигрируют и заселяют тимус, селезенку, лимфоузлы и некоторые другие органы.
Лимфопоэз происходит в лимфоидной ткани, которая имеет несколько разновидностей, представленных в тимусе, селезенке, лимфоузлах. Она выполняет функции образования T- и B-лимфоцитов и иммуноцитов (например, плазмоцитов).
Миелоидная и лимфоидная ткани являются разновидностями соединительной ткани, т.е. относятся к тканям внутренней среды. В них представлены две основные клеточные линии — клетки ретикулярной ткани и гемопоэтические клетки.
Ретикулярные, а также жировые, тучные и остеогенные клетки вместе с межклеточным веществом формируют микроокружение для гемопоэтических элементов. Структуры микроокружения и гемопоэтические клетки функционируют в неразрывной связи друг с другом. Микроокружение оказывает воздействие на дифференцировку клеток крови (при контакте с их рецепторами или путем выделения специфических факторов).
Таким образом, для миелоидной и всех разновидностей лимфоидной ткани характерно наличие стромальных и гемопоэтических элементов, образующих единое функциональное целое.
СКК относятся к самоподдерживающейся популяции клеток. Они редко делятся. Выявление СКК стало возможным при применении метода образования клеточных колоний – потомков одной стволовой клетки.
Пролиферативную активность СКК регулируют колониестимулирующие факторы (КСФ), различные виды интерлейкинов (ИЛ-3 и др.).
Каждая СКК в эксперименте или лабораторном исследовании образует одну колонию и называется колониеобразующей единицей (сокращенно КОЕ, CFU).
Исследование клеточного состава колоний позволило выявить две линии их дифференцировки.
Одна линия дает начало мультипотентной клетке — родоначальнице гранулоцитарного, эритроцитарного, моноцитарного и мегакариоцитарного рядов гемопоэза (сокращенно КОЕ-ГЭММ).
Вторая линия дает начало мультипотентной клетке — родоначальнице лимфопоэза (КОЕ-Л).
Из мультипотентных клеток дифференцируются олигопотентные (КОЕ-ГМ) и унипотентные родоначальные клетки.
Методом колониеобразования определены родоначальные унипотентные клетки для моноцитов (КОЕ-М), нейтрофильных гранулоцитов (КОЕ-Гн), эозинофилов (КОЕ-Эо), базофилов (КОЕ-Б), эритроцитов (БОЕ-Э и КОЕ-Э), мегакариоцитов (КОЕ-МГЦ), из которых образуются клетки-предшественники. В лимфопоэтическом ряду выделяют унипотентные клетки — предшественницы для B-лимфоцитов и для T-лимфоцитов. Полипотентные (плюрипотентные и мультипотентные), олигопотентные и унипотентные клетки морфологически не различаются.
Все приведенные выше стадии развития клеток составляют четыре основных класса, или компартмента, гемопоэза:
- I класс — СКК — стволовые клетки крови (плюрипотентные, полипотентные);
- II класс — КОЕ-ГЭММ и КОЕ-Л — коммитированные мультипотентные клетки (миелопоэза или лимфопоэза);
- III класс — КОЕ-М, КОЕ-Б и т.д. — коммитированные олигопотентные и унипотентные клетки;
- IV класс — клетки-предшественники (бласты, напр.: эритробласт, мегакариобласт и т.д.).
Сразу отметим, что оставшиеся два класса гемопоэза составляют созревающие клетки (V класс) и зрелые клетки крови (VI класс).
Эритропоэз у млекопитающих и человека протекает в костном мозге в особых морфофункциональных ассоциациях, получивших название эритробластических островков.
Эритробластический островок состоит из макрофага, окруженного одним или несколькими кольцами эритроидных клеток, развивающихся из унипотентной КОЕ-Э, вступившей в контакт с макрофагом. КОЕ-Э и образующиеся из нее клетки (от проэритробласта до ретикулоцита) удерживаются в контакте с макрофагом его рецепторами.
У взрослого организма потребность в эритроцитах обычно обеспечивается за счет усиленного размножения эритробластов. Но всякий раз, когда потребность организма в эритроцитах возрастает (например, при потере крови), эритробласты начинают развиваться из предшественников, а последние — из стволовых клеток.
В норме из костного мозга в кровь поступают только эритроциты и ретикулоциты.
Стволовые клетки
Стволовые клетки обладают уникальными свойствами, так как способны самостоятельно обновляться. Есть несколько категории таких соединений:
- эмбриональные;
- соматические, которые образуются у взрослого человека;
- индуцированные.

Для всех категорий стволовых клеток имеются одинаковые свойства. Примечательно, что они недифференцированные и не имеют специализированных компонентов в своей структуре. Кроме того, они участвуют в процессах пролиферации, когда образуется большое количество клеток. У них есть способность к образованию зрелых элементов, к которым относятся форменные элементы крови.
При гемопоэзе схема кроветворения всегда протекает по одинаковым алгоритмам. Это необходимо для поддержания нормальной функции органов и систем. После рождения происходит постэмбриональный гемопоэз. Регуляция отличается от таковой в случае эмбриональной, имеющей место в утробе
В гистологии гемопоэз тоже имеет важное значение для определения нормальной функции крови. Он выполняет важнейшую функцию по физиологическому развитию кровяных клеток и поддержанию их уровня в допустимых пределах
Гемопоэтические нарушения могут свидетельствовать о появлении очагов патологии.
Продолжительность жизни каждого форменного элемента должна быть строго определенной, и за это тоже отвечает гемопоэз. Физиология процесса и новые теории изучаются до сих пор, но ключевые положения ученым уже известны
Особенно важно строение основных органов кроветворения. В случае возникновения патологии источник проблемы обнаружить несложно, если диагноз так или иначе связан с кроветворением
Вероятно угнетение тех или иных его механизмов.
Характерной особенностью является асимметричное деление, ведущее к формированию в каждой половой клетке по 2 дочерних. В них присутствуют родительские, которые в дальнейшем сохраняют свойства самообновления. Другие переходят в формы специализированных клеток. Стволовые же примечательны тем, что могут распознавать области повреждения и перемещаться туда. За счёт этого обеспечивается возможность обновления тканей.
Регуляция кроветворения
Адекватный и быстрый ответ системы кроветворения на вновь возникающие потребности организма в клетках крови обеспечивают цитокины.
В норме регуляция гемопоэза осуществляется непосредственным влиянием микроокружения и гуморальными факторами, обладающими активирующим или угнетающим действием. Эти факторы получили название цитокины. Они позволяют обеспечивать адекватный и быстрый ответ системы кроветворения на вновь возникающие потребности организма в клетках крови. К цитокинам активирующего типа относятся:
- факторы роста (колониестимулирующие);
- эритропоэтины;
- фактор стволовых клеток;
- интерлейкины и др.
Угнетают клеточную активность и кроветворение следующие субстанции:
- фактор некроза опухоли;
- интерферон-гамма;
- лейкоз-ингибирующий фактор и др.
При этом подавление роста одного вида клеток может приводить к усиленной дифференцировке другого.
Количество клеток в периферической крови регулируется по принципу обратной связи. Так, содержание эритроцитов в крови и насыщение их гемоглобином зависит от потребностей тканей в кислороде. Если она возрастает, то включаются не только компенсаторные механизмы (увеличение частоты дыхания и сердечных сокращений), но и стимулируется эритропоэз.
Типы гематопоэза
Гематопоэз бывает нескольких типов, в зависимости от дифференцирующихся клеток:
- эритропоэз;
- гранулоцитопоэз;
- лимфоцитопоэз;
- моноцитопоэз;
- тромбоцитопоэз.
Эритропоэз
Процесс образования эритроцитов называется эритропоэз или эритроцитопоэз. Он начинается с дифференцировки плюрипотентной стволовой клетки в мультипотентную стволовую клетку, за которой следует колония эритроцитов, образующая клетку-предшественник и проэритробласт. Проэритробласт – это клетка, которая содержит ядро и множество рибосом, в которых начинает синтезироваться гемоглобин. Базофильный эритробласт, меньший по размеру, отличается от проэритробласта. После еще нескольких стадий деления образуется ретикулоцит, который является первой неядерной клеткой, содержащей остатки клеточных органелл. После того, как ретикулоцит теряет свои органеллы, образуется эритроцит. Зрелый эритроцит выполняет свои функции и живет около 120 дней. Затем он расщепляется на селезенку и гемоглобин, который содержался в нем, превращается в печень и выводится из организма в виде билирубина.
Гранулоцитопоэз
Гранулоцитопоэз начинается с плюрипотентной гемопоэтической стволовой клетки. Первым идентифицированным предшественником гранулоцитов является миелобласт. Миелобласт образует промиелоцит и миелоцит. Миелоциты содержат специфические гранулы и делятся на нейтрофилы, эозинофилы и базофилы. Нейтрофильный миелоцит имеет почечное ядро и два типа гранул (азурофильные и специфические). Эозинофильный миелоцит имеет овальное ядро и эозинофильные гранулы. Базофильный миелоцит имеет овальное ядро и азурофильные гранулы. После нескольких последовательных делений миелоцитов образуются метамиелоциты, которые снова делятся на нейтрофилы, эозинофилы и базофилы. Затем следует образование палочковидных и сегментарных гранулоцитов. Время, необходимое для дифференцировки стволовых клеток в зрелые гранулоциты, составляет около 10 дней.
Лимфоцитопоэз
Лимфоцитопоэз – это процесс образования лимфоцитов. Он проходит следующие стадии: гемопоэтические стволовые клетки, клетки-предшественники лимфоцитов, лимфобласты и лимфоциты. Три типа клеток развиваются из клеток-предшественников – B- и T-лимфоцитов и естественных клеток-киллеров (NK-клеток).
Моноцитопоэз
В результате моноцитопоэза образуются моноциты, которые попадают в кровоток и при необходимости превращаются в макрофаги. Процесс образования моноцитов начинается с гемопоэтических стволовых клеток, за которыми следует колония моноцитов, образующая клетки-предшественники, монобласты, промоноциты и моноциты. Время, необходимое для дифференциации зрелого моноцита, составляет около 55 часов.
Тромбоцитопоэз
В процессе тромбоцитопоэза образуются тромбоциты. Он начинается с гемопоэтических стволовых клеток, за которыми следуют колониеобразующие единицы мегакариоциты и тромбоциты. Мегакариоциты представляют собой крупные клетки, из которых протромбоциты образуются путем частичной фрагментации, из которой образуются тромбоциты.
Механизмы регуляции
Чтобы эритропоэз протекал нормально, требуются эритропоэтины, синтезируемые тканями почек. Стимулирующее действие на этот процесс оказывают:
- катехоламины;
- тироксин;
- мужские половые гормоны.
Есть и другое понятие — миелопоэз, при котором образуются форменные элементы, за исключением лимфоцитов. Чтобы изучить в достаточной степени схему кроветворения, надо знать основы морфологии костного мозга. Выработка эритроцитов возможна только при условии достаточного присутствия в тканях фолиевой кислоты и витамина B12. Также для нормального кроветворения требуются:
- кобальт;
- медь;
- железо.

Небольшое количество эритропоэтина вырабатывается, если в организме нет патологий. В этом случае соединение перемещается к красному костному мозгу и взаимодействует там со специальными рецепторами. Результатом становится увеличение выработки гемоглобина. Есть и специальные неспецифические факторы, которые воздействуют на эритропоэз и стимулируют его. К ним относятся:
- андрогены;
- глюкокортикоиды;
- АКТГ.
Такое происходит и в случае стимулирующего воздействия на симпатическую нервную систему. Гемолиз, происходящий внутри клеток, влечет за собой разрушение красных форменных элементов крови. Лейкопоэз имеет место в ткани лимфы и костного мозга. Стимулирующее воздействие на него оказывают так называемые факторы роста. Интерлейкины влияют на лейкопоэз, приводя к усилению производства эозинофилов и базофилов. Стимулировать лейкопоэз способны вещества, образованные после распада микроорганизмов, тканей, а также самих лейкоцитов.
Чтобы тромбоцитопоэз стал возможным, требуются тромбоцитопатины. Они производятся в печени и селезенке. В этих органах происходит экстрамедуллярный гемопоэз. Благодаря этим компонентам обеспечивается нормальное соотношение между образованием пластинок крови, а также процессами их разрушения.
Что будет, если гемопоэз нарушится
К сожалению, встречаются заболевания, при которых нарушается одно или несколько звеньев производства крови. В зависимости от того, на каком уровне это произошло, тяжесть заболевания и его проявления будут варьировать.
Нарушение производства эритроцитов
Такое состояние возникает, если эритропоэз остановился до полного образования эритроцита. Основными проявлениями проблемы будут:
- снижение уровня гемоглобина в крови
- появление патологических форм гемоглобина
- повышенное разрушение недозрелых форм леток и, как
- следствие, появление желтухи
Нарушение производства лейкоцитов
Обычно такое нарушение связано с повышенной выработкой миелобластов или лимфоцитов, при этом развивается состояние знакомое всем как лейкоз. Клинически лейкоз появляется снижением общего иммунитета, присоединением множества инфекций и ненормальной реакцией организма на обычные процессы.
Нарушение производства тромбоцитов
Изменения в этом звене гемопоэза очень опасны, так как быстрее предыдущих ведут к гибели. Вся причина в том, что несовершенные тромбоциты не могут адекватно выполнить адгезивную функцию. Следовательно, даже малейшие повреждения будут сопровождаться массивными кровотечениями.
В заключении хочется сказать, что тонкие механизмы гемопоэза, практически не подвластны человеческому воздействию. Поэтому возникшие в них ошибки исправить бывает очень трудно.
Сен 29, 2016
Что представляет собой процесс кроветворения и где он происходит
Сам по себе гемопоэз — это многоэтапная последовательность получения взрослых кровяных клеток из клеток, которые являются их предшественниками и в норме не встречаются в циркулирующей по сосудам крови. Зрелыми называются клетки, которые обычно обнаруживаются в нормальном анализе крови человека.
Человеческие клетки
Где же происходят все эти сложные процессы? Клетки предшественницы образуются в ряде органных структур человеческого тела.
- Основным коллектором кроветворных процессов является костный мозг. Все действо идет в полостях костей, где находится стромальное микроокружение. К частичкам такого окружения относятся клетки, выстилающие сосуды, фибробласты, костные клетки, жировые и многие другие. Все, что их окружает, состоит из белков, различных волокон, между которыми находится основное костное вещество. В строме есть адгезивная составляющая, которая как бы притягивает основные кроветворящие клетки. Самые «первые» структуры схемы гемопоэза находятся в костном мозге. Родоначальники лимфоцитов образуются здесь же, а дозревают потом в вилочковой железе и селезенке, а также в лимфоузлах.
- Селезенка – еще один немаловажный орган. Она состоит из красной и белой зон. В красной зоне складируются и разрушаются эритроциты, в белой зоне обитают т-лимфоциты. Склады в-лимфоцитов находятся по окружности от красной зоны.
- Вилочковая железа – основной «завод» по производству лимфоцитов. Туда попадают из костного мозга недозрелые клетки. В тимусе они очень быстро преобразуются, большая часть из них гибнет, а выжившие превращаются в хелперов и супрессоров и направляются к селезенке и лимфоузлам. Чем старше человек, тем меньше его вилочковая железа. Со временем она полностью редуцируется, становясь комком жира.
- Лимфоузлы – это так называемые иммунные ответчики, которые за счет предоставления антигена первые реагируют на изменения в иммунитете. По периферии узла находятся Т-лимфоциты, а в сердцевине – зрелые клетки.
- Пейеровы бляшки – аналог узлов, только расположены они по ходу кишечника.
Таким образом, практически все органы напрямую или косвенно связаны с кроветворением.
Лечение апластической анемии
Лечение идиопатической и других видов апластической анемии – очень сложная задача, требующая комплексного индивидуального подхода. При разработке тактики специалисты ЦЭЛТ учитывают результаты диагностики и показания пациента. Больного помещают в изолятор с асептическими условиями, что позволяет исключить риск развития инфекций и их осложнений. Медикаментозная терапия заключается в приёме:
- Глюкокортикоидов – при выявлении аутоиммунных механизмов и формировании антител против собственных кровяных клеток;
- Цитостатиков – при отсутствии эффекта от лечения глюкокортикоидами при аутоиммунной анемиии;
- Циклоспорина «А» – для подавления производства ФНО и интерферона “y”;
- Анаболиков – для стимулирования функции кроветворения;
- Андрогенов – для стимулирования образования красных кровяных клеток.
Всем больным апластической анемией проводят переливание эритроцитарной и/или тромбоцитарной массы, в объёмах, определяемых исходя из клинической картины и показателей периферической крови. Кроме того, пациенту могут назначить спленэктомию – хирургическое вмешательство, направленное на удаление селезёнки. Самые благоприятные прогнозы может обеспечить трансплантация костного мозга. Она заключается в пересадке донорских или собственных стволовых кроветворных клеток, предварительно изъятых из подвздошных костей путём пункции. К сожалению, процедура недоступна для широкого применения из-за сложности подбора совместимого донора. В том случае, если это невозможно, пациенту назначают паллиативную терапию с применение циклоспорина А.
В отделении гематологии нашей клиники ведут приём кандидаты, доктора и профессоры медицинских наук с опытом практической и научной работы от двадцати пяти лет. Вы можете записаться к ним на приём онлайн или обратившись к нашим операторам. Специалисты высокой квалификации работают и в отделении . К ним можно записаться на
В ЦЭЛТ вы можете получить консультацию гематолога.
- Первичная консультация — 3 200
- Повторная консультация — 2 000
Записаться на прием
Записавшись на прием гематолога, вы сможете получить всестороннюю консультацию. В компетенции врача находится лечение различных заболеваний крови, большинство из которых можно выявить на ранних стадиях и назначить своевременное лечение, позволяющее справиться с болезнью быстро и легко.
Наши врачи
Тюкалова Наталья Рудольфовна
Врач-гематолог, педиатр, кандидат медицинских наук
Стаж 29 лет
Записаться на прием
Дворецкий Леонид Иванович
Врач-терапевт, гематолог, доктор медицинских наук, профессор
Записаться на прием
Лабораторные исследования
- Клинический анализ крови — 950
руб. - Коагулограмма развернутая — 2 000
руб. - Обмен железа (железо несвязанное, трансферин) — 700
руб. - Витамин В 12 — 650
руб. - Фолиевая кислота — 650
руб. - Цитологическое исследование пунктатов (1 локализация) — 1 900
руб. - Цитологическое исследование пунктатов щитовидной железы и других органов и тканей (1 локализация) — 1 900
руб. - Гистологическое исследование биопсийного материала лимфоузлов — 3 500
руб. - Гистологическое исследование биопсийного материала ткани костного мозга — 4 500
руб.
- (печень, желчный пузырь, поджелудочная железа, селезенка) — 3 800 руб.
- УЗИ лимфатических узлов, комплексное (несколько регионов) — 3 000 руб.
- Ультразвуковое исследование и компрессионная поверхностных лимфатических узлов — 4 000 руб.
Рентгенологические исследования
Рентгенография органов грудной клетки (обзорная) — 2 500 руб.
Компьютерная и
- гепато-панкреато-дуоденальной области и селезенки — 11 000 руб.
- МР томография органов брюшной полости (печень, желчный пузырь, поджелудочная железа, селезенка) с внутривенным введением контрастного вещества — 14 000 руб.
Депо крови
Депо крови – это ткани или органы, способные накапливать значительное количество крови, которая может использоваться организмом при необходимости
В состоянии покоя около 5% циркулирующей крови находится в капиллярах, а также в сердце, 20% в артериях и 70% в венах, что свидетельствует о важности венозных сосудов и в качестве резервуара крови. Таким образом, некоторые сосудистые области – печень, подкожная клетчатка, легкие, брюшные вены и селезенка – играют роль складов крови, из которых, при необходимости, больше крови включается в артериальное кровообращение
Значение селезенки как депо крови было разъяснено Д. Араховацем. Это очень крупное депо крови, где накапливается около 8-12% её объема. Печень также способна хранить значительное количество крови, но не так много, как селезенка. Кровь в печени сосредоточена в синусоидах.
При кровопотере в результате симпатической стимуляции венозные сосуды в хранилищах (депо) крови сужаются, и вытесненная ими кровь может компенсировать уменьшение объема циркулирующей крови
Важно отметить, что компенсация возможна, когда речь идет о потере 20% от общего количества крови (эквивалентно примерно 1 литру крови). Это причина, по которой внезапные небольшие кровопотери у здоровых людей (при рождении, сдаче крови) относительно хорошо переносятся и не вызывают значительных нарушений гемодинамики
Когда, однако, потеря крови происходит быстро и носит массивный характер (более 1/3 общего объема крови), организм не в состоянии это компенсировать. Затем, из-за общего нарушения кровообращения, может наступить смертельный исход.
В связи с тем, что объем и линейная скорость крови в хранилищах крови очень низкие, создаются условия для удержания стенок клеток крови. В результате значение гематокрита крови в хранилищах крови увеличивается.
Физиологические основы
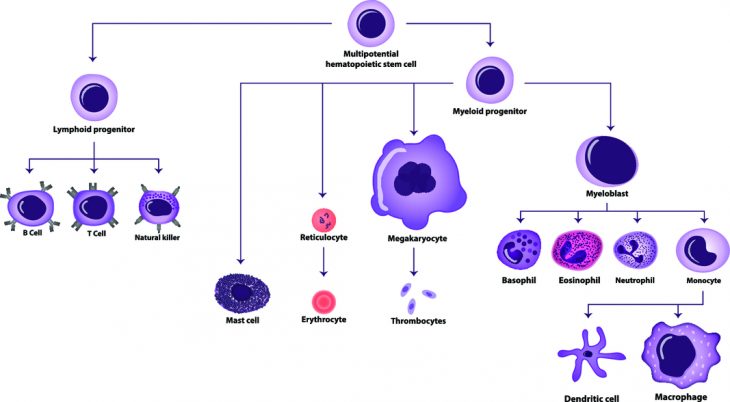 Все клетки крови развиваются из одной гемопоэтической стволовой клетки.
Все клетки крови развиваются из одной гемопоэтической стволовой клетки.
Гемопоэз представляет собой многостадийный процесс деления и дифференцировки гемопоэтической стволовой клетки, конечным результатом которого является поступление в кровеносное русло всех форменных элементов крови.
Эти стволовые клетки закладываются в организме человека в процессе эмбрионального развития в большом объеме, превышающем его нужды в течение всей жизни. Они активируются и вступают в свой жизненный цикл по мере необходимости для обеспечения достаточного количества клеточных элементов в периферической крови.
В процессе гемопоэза можно выделить два крупных ответвления:
- миелопоэз (образование клеток тромбоцитарного, гранулоцитарного, моноцитарного, эритроцитарного ряда);
- лимфопоэз (созревание лимфоцитов).
Контроль гемоцитопоэза
Гемоцитопоэз объединяет процессы, связанные с преобразованием различных клеток в зрелые элементы крови. Так обеспечивается естественное сокращение лишнего количества форменных элементов. Полипотентные стволовые клетки самостоятельно проходят регенерацию. Они могут образовываться вне органов кроветворения. При стандартной дифференциации полипотентные клетки, сосредоточенные в костном мозге, способствуют зарождению зрелых элементов крови. Это:
- базофилы;
- эритроциты;
- различные типы лимфоцитов;
- эозинофилы;
- нейтрофилы.
К ним относят:
- попадание инфекции в организм;
- механические повреждения и другие факторы, способствующие потере определенного количества крови;
- адаптация к условиям высокогорья.
Апластическая анемия: симптомы
Заболевание начинается остро, оно сопровождается ощущением сильной слабости и быстрой утомляемостью. Кожные покровы больного и видимые слизистые оболочки выглядят бледными, а сам он страдает от следующих клинических проявлений:
- шум в ушах;
- появление одышки даже при несущественных усилиях;
- неприятное покалывание в области грудной клетки.
При снижении количества тромбоцитов в единице объёма крови проявляется геморрагический синдром:
- даже после незначительной компрессии или ударах кожного покрова на нём появляются синяки и кровоизлияния;
- на теле, руках и ногах можно увидеть сыпь в виде мелких точек;
- наблюдается кровоточивость дёсен;
- спонтанные кровотечения из носа;
- обильные менструации (у женщин).
Снижение количества лейкоцитов в единице объёма крови характеризуется регулярным частым развитием инфекционных заболеваний кожи и структур мочевыводящей системы, воспалительными процессами слизистой оболочки рта, воспалениями лёгких.
Врождённая форма анемии развивается у детей до десяти лет и сопровождается целым рядом других нарушений:
- недоразвитие черепа и головного мозга;
- снижение размеров и массы почек (гипоплазия);
- интенсивная окраска отдельных участков кожи – гиперпигментация;
- сильное снижение слуха и нарушения речевой функции из-за него.