Макролиды — атх-классификация лекарственных препаратов
Содержание:
- Классификация
- Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
- Применение макролидов в клинике
- Список препаратов
- Описание
- Таблица. Антимикробный спектр эритромицина и олеандомицина
- Фарматека №5 / 2019
- Кеталиды
- Миф. Тетрациклины традиционно «слабые» антибиотики, значительно менее мощные, чем пенициллины
- Безопасность макролидов
Классификация
Антибиотики ряда макролидов делятся по способу получения на природные и синтетические, по химической структуре на 14-, 15- и 16-членные, по поколениям на первое, второе и третье, по продолжительности действия на быстрого и продолжительного. Основная классификация:
|
14-членные |
15-членные (азалиды) |
16-членные |
|
|
Природные |
Эритромицин, олеандомицин (первого поколения) |
Мидекамицин, спирамицин, лейкомицин, джозамицин (третьего поколения) |
|
|
Пролекарства |
Пропионил, этилсукцинат, стеарат, фосфат, аскорбинат, сукцинат эритромицина, тролеандомицин, гидрохлорид, фосфат олеандомицина |
Миокамицин (ацетат мидекамицина) |
|
|
Полусинтетические |
Рокситромицин, кларитромицин, флуритромицин, кетолид телитромицин |
Азитромицин (второго поколения) |
Рокимитацин |
Миф. Чтобы вылечиться побыстрее, нужны «сильные» антибиотики широкого спектра действия
Правда. Все зарегистрированные антибактериальные препараты можно смело относить к мощным, то есть «сильным», однако выраженность их противомикробного эффекта зависит от множества факторов, объединенных принципами антибиотикотерапии :
- Установка диагноза настолько точная, насколько это возможно. Знание диагноза позволяет определить предполагаемого возбудителя.
- Определение возбудителя, если это возможно.
- Принятие взвешенного решения о необходимости назначения антибиотиков.
- Подбор оптимального антибиотика с учетом фармакокинетики и спектра активности.
- Подбор оптимальной дозы и курса лечения (последний при большинстве острых инфекций должен составлять не менее 5–10 дней).
- Контроль эффективности антибиотикотерапии.
В российских реалиях, когда контроль за приемом антибиотиков, откровенно говоря, недостаточен, особенно остро стоит вопрос некорректного подбора препаратов. Известно, что его осуществляют двумя способами: этиотропным и эмпирическим. В первом случае антибиотик применяется целенаправленно против определенного, точно установленного возбудителя. Без сомнения, это рационально и оправданно. Однако идентификация микроорганизма, вызвавшего инфекцию, требует времени, обычно это занимает несколько суток. Когда процесс протекает остро и больному требуется немедленная помощь, выделение возбудителя — неоправданная роскошь. В такой ситуации назначают эмпирическую терапию, подбирая препарат с учетом наиболее вероятных возбудителей . Например, самый частый возбудитель пневмонии — пневмококк, цистита — кишечная палочка и так далее.
Если антибиотик был подобран корректно и все остальные принципы антибиотикотерапии были соблюдены, он, без сомнения, окажется «сильным». А вот тот же препарат, применяемый неправильно (независимо от того, на каком этапе была сделана ошибка), может проявить «слабость» и не оказать терапевтического действия.
Применение макролидов в клинике
М. малотоксичны, побочные реакции наблюдаются редко; применяются в качестве резервных препаратов при заболеваниях, вызванных устойчивыми к другим антибиотикам микроорганизмами, у больных с аллергией к природным и полусинтетическим пенициллинам. Эритромицин эффективен при большинстве бактериальных инфекций. Его применяют для лечения инфекций, вызванных стафилококками, пневмококками, стрептококками, палочкой инфлюэнцы. Эритромицин особенно эффективен при стафилококковых инфекциях: тонзиллите, бронхите, пневмониях, сепсисе, гнойных отитах, фурункулезе, простатите, воспалительных заболеваниях матки, а также при дифтерии (больные и носители), скарлатине; применяется для терапии анаэробных инфекций; является средством выбора в случае аллергии к пенициллинам. Лечение эритромицином пневмоний, вызванных Mycoplasma pneumoniae, более эффективно по сравнению с терапией тетрациклином. Эритромицин концентрируется в печени, почках и селезенке, а затем выделяется с желчью (до 20—30% принятой дозы) и мочой (до 15% дозы, введенной внутривенно, и 2—8% дозы, принятой внутрь), поэтому может применяться при лечении инфекций желчевыделительных и мочевыводящих путей, вызываемых не только чувствительными, но и относительно устойчивыми возбудителями. Установлена высокая активность эритромицина при лечении так наз. болезни легионеров (см. Легионеров болезнь).
Внутрь применяют эритромицин — основание или стеарат в таблетках, содержащих 250 мг препарата. Средняя разовая доза эритромицина для взрослых 0,25 г, при тяжелых заболеваниях — 0,5 г; принимают через 4—6 час. за 1—0,5 часа до еды. Детям эритромицин назначают из расчета 20—40 мг/кг, при тяжелом течении заболеваний возможно внутривенное применение эритромицина фосфата в дозе 200 мг 2—3 раза в сутки. Высшая разовая доза для взрослых внутрь 0,5 г, суточная 2 г. Абсолютных противопоказаний к применению антибиотика нет
Эритромицин с осторожностью применяют при повышенной чувствительности к нему, тромбофлебите, поражениях печени, почек с нарушением их функции.
Побочные действия при приеме эритромицина встречаются редко, он относится к хорошо переносимым препаратам. У больных могут наблюдаться тошнота, рвота, диарея, иногда лихорадка, эозинофилия, кожные высыпания. Если лечение продолжается более 10—12 дней, эритромицина эстолат может вызвать поражение печени, проявляющееся болью в животе, тошнотой, ахоличным стулом, темной мочой, желтухой, увеличением печени с повышением билирубина и щелочной фосфатазы в крови.
Олеандомицин по спектру действия напоминает эритромицин, но обладает несколько меньшей активностью. Показания к применению те же, что и эритромицина. Олеандомицина фосфат применяют в таблетках и капсулах для приема внутрь, для внутривенного и внутримышечного введения. Разовая доза для взрослых при приеме внутрь 0,25 г, суточная 2 г; суточная доза для детей 20—30 мг/кг. Внутривенно вводят взрослым 1—2 г, детям 30—50 мг/кг.
Триацетилолеандомицин (ТАО) — производное Олеандомицина для приема внутрь; применяют в виде суспензии для лечения детей в дозах, близких к дозам Олеандомицина.
Побочные действия при приеме Олеандомицина выражаются в аллергических явлениях, местно-раздражающем действии на жел.-киш. тракт. Противопоказанием к его применению является повышенная индивидуальная чувствительность
Следует соблюдать осторожность, назначая препарат при нарушении функции печени, почек. При применении ТАО описаны Гепатотоксические явления.
Список препаратов
Макролиды – препараты, список которых весьма широк. Всего по состоянию на 2015 год существует 12 лекарственных веществ данного класса. А количество препаратов, содержащих данные действующие вещества, намного выше. Многие из них можно встретить в аптечной сети и принимать для лечения ряда заболеваний. Причем часть препаратов недоступна в СНГ, так как не зарегистрирована в фармакопее. Примеры торговых наименований препаратов, содержащих макролиды, следующие:
- Эритромицин часто выпускается в препаратах с аналогичным названием, а также входит в комплексные лекарства “Зинерит” и “Изотрексин”.
- Олеандомицин – лекарственное вещество препарата “Олететрин”.
- Кларитромицин: “Клабакс” и “Кларикар”, “Клеримед” и “Клацид”, “Клерон” и “Лекоклар”, “Пилобакт” и “Фромилид”, “Экозитрин” и “Эрасид”, “Зимбактар” и “Арвицин”, “Киспар” и “Кларбакт”, “Кларитросин” и “Кларицин”, “Класине” и “Коатер”, “Клеримед” и “Ромиклар”, “Сейдон” и “СР-Кларен”.
- Рокситромицин часто встречается в виде непатентованного торгового названия, а также входит в состав следующих препаратов: “Кситроцин” и “Ромик”, “Элрокс” и “Рулицин”, “Эспарокси”.
- Азитромицин: “Азивок” и “Азидроп”, “Азимицин” и “Азитрал”, “Азитрокс” и “Азитрус”, “Зетамакс” и “Зи-Фактор”, “Зитноб” и “Зитролид”, “Зитрацин” и “Сумаклид”, “Сумамед” и “Сумамокс”, “Суматролид” и “Тремакс-Сановель”, “Хемомицин” и “Экомед”, “Сафоцид”.
- Мидекамицин выпускается в виде препарата “Макропен”.
- Спирамицин выпускается как “Ровамицин” и” Спирамицин-Веро”.
- Диритромицин, флуритромицин, а также телитромицин и джосамицин не выпускаются в СНГ.
Описание
Макролиды оказывают бактериостатическое действие и преимущественно активны в отношении внутриклеточных возбудителей (хламидии, микоплазмы, легионеллы) и грамположительных кокков (кроме MRSA и энтерококков). В последние годы резко снизилась активность в отношении пневмококков и стрептококков, что необходимо учитывать при выборе ЛС для респираторных инфекций. Грамотрицательные микроорганизмы семейства Enterobacteriaceae, Р. aeruginosa и грамотрицательные анаэробы к макролидам природно резистентны. Из других грамотрицательных бактерий определенную чувствительность к макролидам проявляют моракселлы, бордетеллы, нейссерии, кампилобактеры и хеликобактеры
Практически важное значение имеет активность некоторых макролидов в отношении атипичных микобактерий и простейших (токсоплазм). Среди макролидов умеренной активностью против Н
influenzae in vitro обладают только азитромицин и кларитромицин.
Макролиды удовлетворительно всасываются при пероральном приеме (пища снижает биодоступность) и распределяются во многих тканях и секретах (плохо проникают через ГЭБ). Создают высокие тканевые и внутриклеточные концентрации. Метаболизируются в печени, выводятся в основном через ЖКТ. При почечной недостаточности коррекцию доз не проводят (исключение — кларитромицин).
Наиболее частые нежелательные реакции — диспептические явления. Аллергические реакции наблюдаются редко. При в/в введении может развиваться флебит. Эритромицин у новорожденных может способствовать развитию пилоростеноза.
Большинство ЛС (особенно эритромицин и кларитромицин) является сильными ингибиторами изоферментов цитохрома Р450, поэтому на фоне их применения ослабляется в/м биотрансформация и повышается концентрация в плазме (сыворотке) крови ЛС, метаболизирующихся в печени (в т.ч. теофиллин, варфарин, циклоспорин). Также возможно удлинение интервала QT. Макролиды применяют при инфекциях верхних и нижних дыхательных путей (преимущественно вызванных «атипичными» возбудителями), урогенитальных инфекциях, вызванных хламидиями и микоплазмами, при инфекциях кожи и мягких тканей. Эритромицин — препарат выбора при легионеллезе, для профилактики острой ревматической лихорадки (при аллергии к пенициллину) и для деконтаминации кишечника перед колоректальными операциями. Кларитромицин используют для лечения и профилактики оппортунистических инфекций при СПИДе, вызванных некоторыми атипичными микобактериями, а также для эрадикации Н. pylori при язвенной болезни желудка и двенадцатиперстной кишки. Спирамицин применяют для лечения токсоплазмоза, в т.ч. у беременных.
Преимущества спирамицина, кларитромицина, азитромицина, рокситромицина, мидекамицина и джозамицина перед эритромицином: улучшенная фармакокинетика, переносимость и меньшая кратность применения. 16-членные макролиды (спирамицин, джозамицин и мидекамицин) в меньшей степени ингибируют изоферменты цитохрома Р450, не обладают прокинетическими свойствами и активны в отношении некоторых штаммов стрептококков и пневмококков, устойчивых к 14- и 15-членным макролидам.
Таблица. Антимикробный спектр эритромицина и олеандомицина
|
Виды бактерий |
Минимальная подавляющая концентрация антибиотика, (МПК), мкг/мл* |
|
|
эритромицин |
олеандомицин |
|
|
Staphylococcus aureus |
0,01—20 |
0,19—3 |
|
Streptococcus pyogenes |
0,0125-1, 5 |
0,078 |
|
Streptococcus faecalis |
0,02—6 |
0,3—4 |
|
Streptococcus viridans |
0,02—3 |
0,15-1,25 |
|
Streptococcus pneumoniae |
0,01-0,2 |
0,07—3 |
|
Corynebacterium diphtheriae |
0 ,004—3 |
1,56—2 |
|
Erysipelothrix rhusiopathiae |
0,2-0,4 |
0,2-0,4 |
|
Бактерии рода Clostridium |
0,2-0,5 |
3,12—6,25 |
|
Бактерии рода Brucella |
0,4—20 |
6,25-20 |
|
Neisseria meningitidis |
0,2-0,3 |
1,56 |
|
Neisseria gonorrhoeae |
0,04 —5 |
3,12 |
|
* Большой диапазон МПК объясняется неодинаковой |
Библиография: Машковский М. Д. Лекарственные средства, ч. 2, с. 183 и др., М., 1977; Навашин С. М. и Фомина И. П. Справочник по антибиотикам, с. 117, М., 1974; Antimicrobial therapy, ed. by В. М. Kagan, p. 71, Philadelphia a. o., 1974.
Фарматека №5 / 2019
Оглавление номера
21 мая 2019
1) Смоленский государственный медицинский университет, Смоленск, Россия;
2) Смоленская областная клиническая больница, Смоленск, Россия
Рокситромицин является классическим представителем 14-членных макролидов и имеет ряд клинически значимых терапевтических особенностей. Фармакодинамические и фармакокинетические свойства рокситромицина в сочетании с высокой безопасностью подтверждены в многочисленных клинических исследованиях. Высокая эффективность антибиотика вне зависимости от кратности его назначения позволяет широко использовать рокситромицин в лечении инфекций как у взрослых, так и у детей.
Для цитирования: Егорова О.А. Макролидный антибиотик рокситромицин – основные клинико-фармакологические аспекты применения. Фарматека. 2019;26(5):29–38. DOI: https://dx.doi.org/10.18565/pharmateca.2019.5.29-38
Введение
Макролидные антибиотики зарегестрированы более 50 лет назад с появления первого препарата данного ряда – . В течение последующих лет разработка новых групп макролидов значительно снизилась по сравнению с другими группами антибактериальных препаратов (АБП). Интерес к макролидным антибиотикам возрос с появлением на фармацевтическом рынке 14- и 15-членных макролидов, а также доказательной базы внутриклеточных патогенов (Chlamydia spp., Legionella spp. и др.) в ряде инфекций и возникновением проблемы вторичной лекарственной устойчивости микроорганизмов в первую очередь к β-лактамным антибиотикам .
В основе механизма действия макролидных антибиотиков лежит их способность нарушать синтез белка микробной клетки. При этом в терапевтических концентрациях макролиды оказывают преимущественно бактериостатическое действие, однако в высоких концентрациях эти препараты могут действовать бактерицидно . После выхода на фармацевтический рынок более новых препаратов группы макролидов использование значительно снизилось. Это объясняется фармакокинетическими и фармакодинамическими преимуществами «новых» макролидов по сравнению с : снижение кратности введения препарата и степени влияния компонентов пищи на биодоступность препаратов, более широкий спектр действия некоторых 14-, 15- и 16-членных представителей группы, а также менее выраженные побочные эффекты и лекарственные взаимодействия. Однако для сравнительной оценки антимикробной эффективности макролидных антибиотиков проводится их сопоставление именно с , который принято считать «стандартным препаратом группы макролидов» .
В настоящее время известно 14 макролидов, из них в России зарегистрировано 8 представителей данного класса антибиотиков . Наиболее распространенным является – первый полусинтетический 14-членный макролид. Препарат был разработан фармацевтической компанией Hoechst Uclaf и появился на фармацевтическом рынке в 1987 г. . обладает особенностями, отличающими его от других представителей класса макролидов, прежде всего , что позволяет рассматривать его в качестве клинически значимого АБП при лечении многих заболеваний.
Фармакологические свойства
– полусинтетический антибиотик группы макролидов для приема внутрь. Оказывает бактериостатическое действие: связываясь с 50S-субъединицей рибосом, подавляет реакции транслокации и транспептидации, процесс образования пептидных связей между аминокислотами и пептидной цепью; тормозит синтез белка рибосомами, в результате чего угнетает рост и размножение бактерий. проявляет свою активность за счет создания более высоких внутриклеточных концентраций . Химическая структура представлена на рис. 1 .
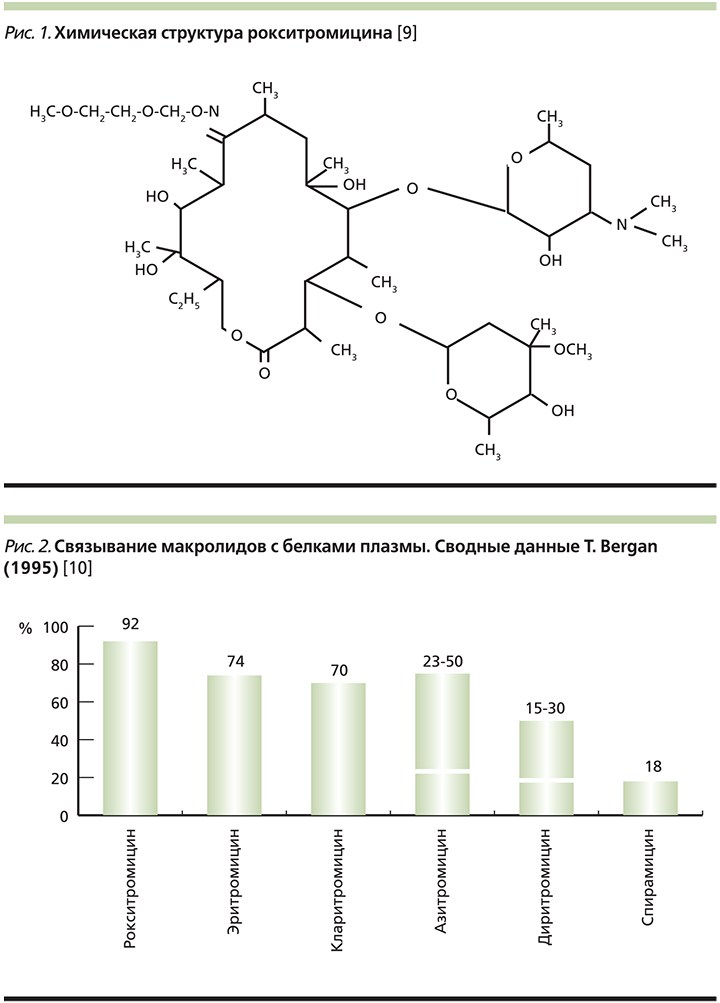
Спектр активности приближается к таковому , но при этом имеет ряд преимуществ. Модификация лактонного кольца привела к появлению трех кардинальных отличий от : расширение спектра антибактериальной активности, прежде всего за счет грамотрицательной флоры (Haemophilus influenzae, Neisseria spp. и некоторых других грамотрицательных палочек), более высокая кислотоустойчивость и улучшенная всасываемость в желудочно-кишечном тракте (ЖКТ), способность создавать более высокие концентрации в клетках и увеличение продолжительности периода полувыведения .
Фармакокинетика
имеет более высокую биодоступность при приеме внутрь, более устойчив к действию соляной кислоты, лучше и быстрее, чем другие макролиды, всасывается в ЖКТ. Пища не влияет на полноту абсорбции
DOI: https://dx.doi.org/10.18565/pharmateca.2019.5.29-38
О.А. Егорова
Кеталиды
Пикромицин, 14-членный макролид без сахара кладинозы, был первым идентифицированным макролидным антибиотиком, но из-за низкой активности он не был разработан, и эритромицин стал ядром для разработки новых макролидов.
Изучив химические процессы тилозина и пикромицина, химики фармацевтической компании Aventis разработали телитромицин. В телитромицине боковая цепь в положении 11, 12 имитировала боковую цепь сахара 16-членных макролидов, а кетогруппа заменила кладинозу, делая молекулу меньше, как у пикромицина.
Телитромицин — несостоявшийся новый макролид
Как и в случае соединений, произведенных в Abbott Laboratories. , телитромицин обладал активностью в отношении штаммов, устойчивых к макролидам, но также имел в 4-8 раз большую эффективность, чем более старые макролиды. Со-кристаллические структуры подтвердили, что, как и более старые макролиды, телитромицин связывается с пептидным туннелем на 23S РНК 50S. рибосома и взаимодействовал с доменом V, связывающимся с A2058 и A2059.
Кроме того, он также дистанционно взаимодействовал в Домене II через боковую цепь14. Активность телитромицина против макролидорезистентных бактерий, как сообщается, связана с тем фактом, что телитромицин взаимодействует с бактериальной рибосомой в двух разных участках.
Казалось бы телитромицин — представитель «макролидов нового поколения» — кеталидов — более активных и без резистентных штаммов. Что может пойти не так? Препарат одобрили под торговым названием «КЕТЕК» — производители отдали должное кетонной группе препарата, но вскоре после этого он ушел с рынка по причине серьезных побочных эффектов:
- Обратимое нарушение зрения
- Острая печеночная недостаточность
- Потеря сознания
- Обострение миастении Гравис
Миф. Тетрациклины традиционно «слабые» антибиотики, значительно менее мощные, чем пенициллины
Правда. На самом деле тетрациклины имеют широкий спектр антибактериальной активности, причем современные их представители действуют в отношении еще большего количества бактерий, чем их предшественники, включая ряд возбудителей, устойчивых к другим классам антибиотиков. Так, тигециклин, появившийся на рынке только в середине 2000‑х, был разработан в рамках программы по борьбе с растущей антибиотикорезистентностью таких «сложных» в этом плане возбудителей, как золотистый стафилококк и кишечная палочка .
Тетрациклины, в том числе и применяемые на протяжении десятилетий тетрациклин и доксициклин, способны проникать внутрь клетки, поэтому они и сегодня широко применяются для лечения внутриклеточных инфекций, передающихся половым путем (хламидиоза, уреаплазмоза, микоплазмоза). К показаниям к их назначению относится и хеликобактерная инфекция — в составе эрадикационной терапии. Благодаря эффективности в отношении Propionibacterium acne тетрациклины наряду с макролидами применяются для лечения угревой болезни. Миноциклин, чей спектр включает Neisseria meningitidis, используется для профилактики менингококковой инфекции .
В качестве ложки дегтя следует упомянуть и о том, что для большинства тетрациклинов (за исключением современных представителей) свойственны высокий уровень вторичной резистентности многих бактерий и к тому же перекрестная устойчивость микроорганизмов . И это, несомненно, во многих случаях снижает их актуальность.
Безопасность макролидов
Макролиды — группа антибиотиков,
которые, кроме антимикробного действия, проявляют также противовоспалительные,
иммуномодулирующие и мукорегулирующие свойства. Отличаются хорошей
переносимостью. Их применение не сопровождается артро- и хондропатиями, нефро-
и гематотоксичностью, нежелательными лекарственными реакциями, которые
проявляются при использовании других антимикробных лекарственных средств. После
прекращения приема препаратов все неприятные реакции, как правило, купируются.
Побочные явления со стороны ЖКТ
При
лечении макролидами к побочным эффектам со стороны органов пищеварения
относятся диспепсические явления в виде диареи, рвоты и болей в животе. Они
возникают на фоне стимуляции сокращений кишечника, например, при приеме
эритромицина. Но диарея встречается в 6% случаев, протекает легко и не требует
отказа от приема лекарства. У «новых» макролидов прокинетический эффект выражен
слабее и пациенты их переносят гораздо легче.
Реакции со стороны кровеносной системы
Кардиотоксичность
макролидов проявляется у пациентов с сопутствующими заболеваниями и другими
факторами риска. Во избежание нарушений со стороны сердечно-сосудистой системы
рекомендовано тщательное дозирование макролидов, мониторинг ЭКГ, отказ от
совместного приема лекарственных средств, удлиняющих интервал QT.
У
пожилых пациентов, принимающих макролиды совместно с блокаторами кальциевых
каналов, возможно падение артериального давления. В таких случаях оптимальным
вариантом станет назначение азитромицина.
Другие нежелательные лекарственные реакции:
- При передозировке макролидными
антибактериальными средствами и продолжительном их использовании возможен
холестатический гепатит, который встречается у 3,6/100 тысяч пациентов. - Высокодозная терапия с использованием
эритромицина курсом от 1,5 до 8 суток может стать причиной обратимого ухудшения
слуха. - Макролидные антибактериальные препараты могут
менять микрофлору нижних отделов пищеварительного канала, но такое случается
редко и связано, как правило, с кандидозом или колитом. - Крайне редко встречаются аллергические реакции.
- Антибиотики группы могут индуцировать
нервно-психические расстройства. Поэтому должны назначаться врачом, который при
выборе препарата учитывает состояние пациента, вовремя корректирует дозировки,
меняет назначения. - Необратимые изменения при приеме макролидов
встречаются крайне редко.
Резистентность
некоторых видов бактерий к макролидным антибиотикам продолжает расти.
Критическая ситуация сложилась в Западной Европе. В России уровень
антибиотикорезистентности приближается к 1,5%, в то время как во Франции достиг
58%. Несмотря на это, макролиды относятся к препаратам второй линии, которые
применяются при заболеваниях ЛОР-органов, уступая только защищенным видам
пенициллинов и амоксициллинам. Благодаря благоприятному профилю безопасности,
макролидные антибиотики используются при лечении бронхо-легочных инфекций у
пожилых пациентов, беременных и даже новорожденных детей, которым
противопоказаны тетрациклины. Только врач решает, какому антибиотику отдать
предпочтение, чтобы избежать терапевтических неудач и помочь больному.
Авторитеты
в области медицины считают, что макролиды неоправданно редко используются при
лечении респираторных заболеваний. Чтобы исправить ситуацию необходимо
проводить настойчивую просветительскую работу среди врачей.
Posted by Андрей Титов
Врач общей практики, стаж 10 лет.
Образование:
2005 год Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова (лечебное дело).
2012 год Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова (врач общей практики).