Хронический миелоидный лейкоз
Содержание:
- 2.Симптомы заболевания
- Причины развития
- Подробнее
- Заболевания
- Причины и факторы риска
- Морфологическое строение
- Диагностика Хронического миелолейкоза:
- Хронический миелолейкоз
- Расположение в организме
- Диагностика Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
- Что такое Острый миелоидный лейкоз (острый нелимфобластный лейкоз, острый миелогенный лейкоз) —
- Функция
- Прогноз
- Лейкемоидные реакции: диагностика
- Что такое Острый миелоидный лейкоз (острый нелимфобластный лейкоз, острый миелогенный лейкоз) —
- Классификация острого миелоидного лейкоза
- Рак крови. Симптомы.
- Общее описание
- Что провоцирует / Причины Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
- 3.Диагностика хронического миелолейкоза
- ЛЕЧЕНИЕ РАКА КРОВИ.
- Симптомы Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
2.Симптомы заболевания
Возможными признаками хронического миелолейкоза могут быть усталость, повышение температуры, усиленное потоотделение по ночам. Но все эти признаки могут указывать и на другие проблемы со здоровьем, не только на миелолейкоз. Но в любом случае, лучше обратиться к врачу, если у вас есть вышеперечисленные симптомы, а также если вы замечаете беспричинную потерю веса, боль или чувство наполненности ниже ребер с левой стороны тела. Бывает и так, что хронический миелолейкоз не вызывает вообще никаких симптомов.
У большинства людей с хроническим миелолейкозом в организме есть мутация гена, называемая «филадельфийской хромосомой». Это заставляет костный мозг производить фермент тирозинкиназу, который и является причиной развития слишком большого количества стволовых клеток в лейкоциты (гранулоциты). Филадельфийская хромосома не передается от родителей к детям, а развивается сама по себе как генетический сбой.
Причины развития
Причины развития миелодиспластического синдрома на данный момент не известны. Лишь в 10-15% случаев миелодиспластический синдром развивается у людей, получавших ранее химиотерапию или лучевую терапию по поводу иного заболевания. В остальных случаях предрасполагающими факторами могут быть курение, контакт с определёнными химическими соединениями (бензин, инсектициды, пестициды, ряд органических веществ). Также одной из возможных причин может быть инфицирование парвовирусом В19, так как для него характерно размножение в предшественниках эритроцитов.
Воздействие повреждающих факторов на стволовые клетки костного мозга, являющиеся предшественниками клеток крови, приводит к образованию в них мутаций, которые будут воспроизводиться по мере деления клеток. Дальнейшее накопление мутаций является причиной трансформации миелодиспластического синдрома в острый лейкоз.
Подробнее
Опубликовано: 12.03.2021
Новый анализ крови для диагностики рака простаты
Клиника Дократес первой в Финляндии начала использовать новые анализы крови в дополнение к тестам ПСА для диагностики рака простаты Новый…
Читать далее
Опубликовано: 15.12.2020
Почему пандемия — это не повод отказаться от лечения рака груди
Популярное Интернет-издание Fontanka.ru опубликовало статью о клинике Дократес. Прочитайте, что пишут о нас в российких СМИ.
Читать далее
Опубликовано: 08.12.2020
Почему возникают рецидивы рака молочной железы и как их лечат?
По завершении адъювантной терапии ощущения пациентки могут быть самыми разными: одни радуются успешному завершению лечения, другие чувствуют одиночество. Но большинство,…
Читать далее
Опубликовано: 07.10.2020
Клиника Дократес подписала договор с крупной скандинавской страховой компанией IF
Треть всех онкологических заболеваний, диагностируемых в Финляндии ежегодно, приходится на людей трудоспособного возраста. Быстрое выявление болезни и доступ к лечению…
Читать далее
Подробнее
Заболевания
Наиболее частая проблема, связанная с нарушением созревания и функционирования миелобластов — это острый миелобластный лейкоз (типы M0, M1 и M2 по ФАБ). Основные клинические проявления ОМЛ связаны с нарушением нормальных процессов гемопоэза в результате прогрессирующего избыточного размножения лейкозных миелобластов, нарушения их дифференцировки и вытеснения ими нормальных клеток-предшественников, что приводит к цитопении, в частности анемии, тромбоцитопении и лейкопении, к кровотечениям и инфекциям. При этом процесс является самораскручивающимся по спирали с возрастанием скорости прогрессирования, так как ключевыми факторами, стимулирующими размножение как нормальных, так и лейкозных клеток, является плотность клеток в костном мозге и продукция колониестимулирующих факторов — а она растёт вместе с увеличением численности лейкозного клона. В части случаев острый миелобластный лейкоз вызывается предшествующей химиотерапией или лучевой терапией по поводу другого заболевания, или наличием другого гематологического заболевания, такого, как миелодиспластический синдром, миелопролиферативные синдромы, такие, как хронический миелоидный лейкоз, истинная полицитемия, или, наоборот, панцитопения, гипоплазия костного мозга.
Причины и факторы риска
В настоящее время неизвестно, какие именно воздействия побуждают ростки крови к злокачественным мутациям, однако онкологи хорошо изучили факторы, способствующие развитию острого миелобластного лейкоза.
- Воздействие канцерогенов. Некоторые химические соединения могут побуждать клетки к изменению. Это ряд продуктов, образующихся во время курения табака и неполного окисления жиров, многие виды промышленных выбросов, некоторые лекарственные препараты и т. д.
- Излучение. Рентгеновские лучи и другие радиоактивные, ионизирующие излучения изменяют наследственный аппарат живых клеток.
- Генетический фактор. Риск заболевания повышается в несколько раз для людей, у которых близкие родственники болели лейкозом.
- Заболевания. Некоторые болезни увеличивают вероятность рака крови. Это синдром Дауна, врождённая анемия и тромбоцитопения, нейрофиброматоз и т. д.
Морфологическое строение
Миелобласты — это довольно маленькие клетки, со средним диаметром от 14 до 18 мкм. При этом бо́льшую часть клетки занимает крупное овальное ядро. В ядре наблюдается очень тонкий и нежный неагрегированный (несконденсированный) хроматин и хорошо различимы 3 или более ядрышек. Цитоплазма миелобласта имеет базофильную окраску и лишена специфических гранул, что является главным отличием миелобласта от следующей стадии развития, промиелоцита. Ядрышки являются местами образования рибосомальных белков. Рибосомы расположены в различных участках цитоплазмы клетки. Митохондрии в клетке наличествуют, но имеют довольно малые размеры.
Основные морфологические отличия, которые позволяют отличить миелобласт от лимфобласта при микроскопическом исследовании мазка костного мозга — это присутствие более заметных, хорошо выраженных ядрышек, менее выраженная конденсация (менее плотная упаковка) ядерного хроматина, и наличие неспецифических гранул в цитоплазме клетки.
Диагностика Хронического миелолейкоза:
Стадия течения хронического миелолейкоза устанавливается на основании комплекса клинических данных и изменений со стороны кроветворения с учетом данных гемограммы, миелограммы, гистологического исследования. Иногда недостаточно явная клинико-гематологическая картина на начальном этапе хронической стадии заболевания не позволяет уверенно поставить диагноз хронического миелолейкоза
В этих случаях важное значение для диагностики имеет обнаружение Ph’-хромосомы в гранулоцитах, моноцитах, эритро- и мегакариоцитах костного мозга (следует помнить о вариантах хронического миелолейкоза без Ph’-хромосомы)
Иногда приходится дифференцировать хронический миелолейкоз с идиопатическим миелофиброзом (остеомиелосклерозом), при котором в течение многих лет лейкоцитоз в крови не достигает высоких цифр, обнаруживается увеличение селезенки и печени; в трепанобиоптате костного мозга выявляется значительное разрастание фиброзной ткани. В гемограмме при миелофиброзе может наблюдаться тромбоцитоз, в костном мозге — мегакариоцитоз, гиперплазия эритроцитного ростка, иногда сочетающаяся с увеличением количества эритроцитов в периферической крови. В отличие от хронического миелолейкоза не обнаруживается Ph’-хромосома, отмечается характерная рентгенологическая картина костей скелета; прохождение иглы при пункции грудины и трепанобиопсии подвздошной кости затруднено.
Хронический миелолейкоз
– распространённой вид лейкоза, на его долю приходится около 20% всех лейкозов. В странах Европы и Северной Америки ХМЛ занимает 3-е место по частоте после острых лейкозов и хронического лимфолейкоза. Ежегодная заболеваемость составляет 1-1,5 случая на 100000 населения. Пик заболеваемости приходится на возраст 30-50 лет, около 30% составляют больные старше 60 лет.
ХМЛ возникает вследствие соматической мутации в гемопоэтической стволовой клетке, результатом которой является уникальная цитогенетическая поломка — транслокация t(9;22)(q34;q11) с удлинением длинного плеча одной из хромосом 9 и укорочением одной из хромосом 22. Укороченная хромосома 22 называется филадельфийской и обозначается как Ph-хромосома. Для установления диагноза ХМЛ обязательным диагностическим методом является цитогенетическое исследование крови и/или костного мозга.
В течении ХМЛ выделяют три фазы: 1. хроническую, 2. продвинутую, или фазу акселерации, 3. острую, или терминальную (бластный криз). Продолжительность фаз болезни у разных пациентов различается, ХМЛ может быть впервые диагностирована в любой из них.
Хроническая фаза характеризуется постепенно нарастающим лейкоцитозом – 15-20 х109/л в начале заболевания, иногда до 500-900 х109/л и более при развернутой клинической картине. Одновременно в крови появляются незрелые гранулоциты: миелоциты, метамиелоциты, иногда – промиелоциты, даже единичные бластные клетки. Характерно увеличение числа базофилов до 5-10% и нередко одновременно эозинофилов – эозинофильно-базофильная ассоциация. В большинстве случаев отмечается увеличение количества тромбоцитов. В начале заболевание может протекать почти бессимптомно, через несколько месяцев при осмотре обнаруживается увеличение селезенки, которая без лечения достигает огромных размеров. В таких случаях в ней часто бывают инфаркты, которые сопровождаются выраженным болевым синдромом (острой болью). При выраженной спленомегалии может быть увеличена печень.
Терминальная фаза у 80-85% больных характеризуется развитием бластного криза – появление в крови и костном мозге более 20% бластных клеток. Число лейкоцитов при этом может и не повышаться по сравнению с предыдущей фазой. Как правило, в этой фазе развивается не отмечавшаяся на предыдущих этапах анемия, зачастую одновременно и тромбоцитопения. У большинства больных появляются жалобы на повышение температуры тела, ноющую боль в костях, быстрое увеличение селезенки в размерах.
Цель современной терапии ХМЛ – максимальное подавление Ph-позитивного опухолевого клона. Стандартом в настоящее время является терапия ингибиторами BCR-ABL-тирозинкиназ (ИТК). Препараты из группы ИТК обладают механизмом таргетного действия на Ph-позитивные лейкемические клетки. В настоящее время в клинической практике доступны несколько препаратов (иматиниб, дазатиниб, нилотиниб). Для каждого конкретного пациента терапия может быть выбрана с учетом наибольшей эффективности и наименьшей токсичности. Терапия одним из ингибиторов тирозинкиназ должна быть начата сразу после подтверждения диагноза ХМЛ. Лечение может проводиться в амбулаторных условиях. Прием ИТК можно начинать при любом числе лейкоцитов. После начала приема ИТК число лейкоцитов начинает снижаться через 1-2 недели и нормализуется к 4-6 неделям. Уменьшение повышенного числа тромбоцитов обычно отстает на 1-2 недели. При лечении больных в хронической фазе ХМЛ при снижении числа гранулоцитов менее 1,0х109/л или тромбоцитов менее 50х109/л рекомендуется сделать перерыв в лечении и возобновить его при увеличении количества гранулоцитов до 1,5х109/л, тромбоцитов до 100х109/л.
Для правильной оценки эффективности терапии ингибиторами тирозинкиназ рекомендуется цитогенетическое исследование каждые 6 мес. После достижения полной цитогенетической ремиссии рекомендуется на протяжении всего заболевания каждые 3 мес. проводить молекулярное исследование на наличие BCR-ABL-транскрипта с помощью ПЦР в реальном времени.
Расположение в организме
Миелобласты, как и другие кроветворные клетки, находятся в экстраваскулярных (внесосудистых) пространствах костного мозга. Гемопоэз происходит в этих экстраваскулярных (внесосудистых) полостях или пространствах между синусами костного мозга. Стенки синусов костного мозга выстланы двумя типами клеток — эндотелиальными клетками и адвентициальными ретикулярными клетками. Гемопоэтические стволовые клетки расположены в виде равномерных полос, шнуров или клиньев между этими сосудистыми синусами. При этом миелобласты и другие гранулоцитарные клетки-предшественники расположены в основном в субкортикальных («подкорковых», наиболее близких к корковому слою, то есть к поверхности синуса) этих гемопоэтических «шнуров» или клиньев.
Диагностика Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
Диагноз ОМЛ устанавливается в более 30% случаев определения бластов в костном мозгу. Бласты должны иметь морфологическую и цитохимическую характеристику одного из FAB вариантов ОМЛ.
Цитохимические данные, направленные на диагностику вариантов заболевания, — положительная реакция на миелопероксидазу, с суданом черным Б и неспецифическую эстеразу, ингибируемую фтористым натрием. При этом совокупность данных показателей различается при разных вариантах ОМЛ. Так, наличие положительной реакции на миелопероксидазу характерно для вариантов М1, М2, М3 и М4, а неспецифическая эстераза, ингибируемая фтористым натрием, специфична для вариантов М4 и М5.
Существенным дополнением для диагностики ОМЛ являются иммунофенотипические исследования, уточняющие стандартную морфологическую диагностику и варианты ОМЛ.
Наиболее распространенными и широко применяемыми для подтверждения нелимфоидной природы лейкоза являются антигены CD13 и CD33, несколько реже используется CD65. Оценка этих трех маркеров позволяет подтвердить миелоидную природу опухолевых клеток в 98% случаев ОМЛ у детей.
Хромосомный анализ необходим для прогнозирования результатов лечения ОМЛ. Приблизительно у 75% детей, больных ОМЛ, можно выявить ту или иную хромосомную аберрацию, среди которых есть аномалии, характерные лишь для определенных вариантов ОМЛ. Так, t(8;21) ассоциируется с М2-вариантом, t(15;17) — с М3-вариантом, inv(16) — с М4-вариантом с эозинофилией. Аномалия 11q23 встречается при вариантах М4 и М5 и t(1;22) при М7-варианте. С помощью методов молекулярно-биологической диагностики — полимеразной цепной реакции (ПЦР) и FISH (fluorescent in situ hybridization) — можно определить хромосомную аберрацию, не выявленную при стандартном цитогенетическом исследовании
Это особенно важно для выбора определенного вида лечения в случае подтверждения М3-варианта. Кроме того, благодаря внедрению методов молекулярной диагностики ОМЛ в настоящее время у больных можно констатировать не только клинико-гематологическую, но и молекулярную ремиссию с последующим слежением за минимальной остаточной болезнью и определением молекулярного рецидива
Что такое Острый миелоидный лейкоз (острый нелимфобластный лейкоз, острый миелогенный лейкоз) —
Острый миелоидный лейкоз (ОМЛ) – это онкологическое заболевание, при котором спинной мозг продуцирует аномальные миелобластные клетки (вид лейкоцитарных клеток), эритроциты или тромбоциты.
Острый миелоидный лейкоз встречается у людей всех возрастов, но главным образом — у взрослых. Вероятность развития острого миелоидного лейкоза увеличивается в случае воздействия больших доз радиации и использования некоторых средств химиотерапии по поводу злокачественной опухоли.
Острый миелоидный лейкоз относительно редко встречающаеся злокачественное заболевание. Так, в США ежегодно выявляется 10 500 свежих случаев ОМЛ, а заболеваемость сохраняется неизменной с 1995 по 2005 г. Смертность от ОМЛ составляет 1,2 % всей онкологической смертности в США.
Уровень заболеваемости ОМЛ увеличивается с возрастом, средний возраст выявления заболевания составляет 63 года. На ОМЛ приходится около 90 % всех острых лейкозов у взрослых, но у детей он встречается редко.
Заболеваемость ОМЛ, связанным с предшествующим лечением (то-есть, ОМЛ, вызванным предшествующей химиотерапией) возрастает. В настоящее время такие формы достигают 10-20 % от всех случаев ОМЛ. ОМЛ несколько чаще встречается у мужчин, заболеваемость соотносится как 1,3 к 1.
Существуют некоторые географические отличия в заболеваемости ОМЛ. У взрослых высшая заболеваемость у взрослых приходится на Северную Америку, Европу и Океанию, а в Азии и Латинской Америке заболеваемость ОМЛ ниже. И наоборот, детский ОМЛ в Северной Америке и в Индии встречается реже, чем других частях Азии. Эти различия могут определяться генетическими особенностями населения и особенностями окружающей среды.
Функция
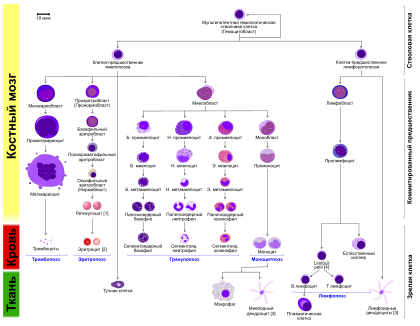
Диаграмма гемопоэза у человека
Гранулопоэз состоит из пяти последовательных стадий. Среди них миелобласт является первой клеткой, распознаваемой как принадлежащая к гранулоцитарному ростку костного мозга. Следующая стадия в процессе дифференцировки миелобласта — это промиелоцит, который, в свою очередь, может дать начало одному из трёх вариантов клеток-предшественников — нейтрофильному, базофильному или эозинофильному миелоциту. Тот, в свою очередь, превращается, соответственно, в нейтрофильный, базофильный или эозинофильный метамиелоцит («юный» гранулоцит). А нейтрофильный, базофильный или эозинофильный метамиелоцит превращается, соответственно, в нейтрофильный, базофильный или эозинофильный палочкоядерный гранулоцит. А тот, в свою очередь, в зрелый сегментоядерный (или «полиморфноядерный») нейтрофил, базофил или эозинофил. Весь этот процесс требует пяти последовательных делений клетки. Все эти пять делений происходят в течение трёх первых стадий гранулопоэза (миелобласт — промиелоцит — миелоцит). Далее идёт только созревание получившейся клетки-миелоцита, дальнейшего деления уже не происходит.
Прогноз
В силу развития цитопенических синдромов, особенно при снижении количества тромбоцитов, само по себе заболевание может быть жизнеугрожающим, но главная опасность миелодиспластического синдрома — перерождение его в острый лейкоз. Для оценки общей продолжительности жизни и риска трансформации миелодиспластического синрома в лейкоз используются две шкалы — International Prognostic Scoring System (IPSS) и шкала ВОЗ. В обеих шкалах используется балльная система, оценивающая кариотип, наличие цитопении (в шкале IPSS) или выраженной анемии (в шкале ВОЗ), а также количество бластов в костном мозге (шкала IPSS) или изначальный вариант миелодиспластического синдрома (шкала ВОЗ). Согласно сумме баллов и оценивается прогноз, а также планируется терапия и динамическое наблюдение.
Миелодиспластический синдром объединяет в себе несколько заболеваний, различных по степени тяжести и по их течению; кроме того, в рамках одного заболевания возможны различные проявления его с различной степенью тяжести. К сожалению, миелодиспластический синдром на данный момент является практически неизлечимым заболеванием, но своевременное обращение к врачу, грамотно подобранная терапия и тщательное динамическое наблюдение способны предотвратить злокачественное перерождение и контролировать его течение, сохраняя пациенту долгую жизнь с минимальным нарушением её качества.
Запись на консультацию круглосуточно
+7 (495) 151-14-53+7 (861) 238-70-54+7 (812) 604-77-928 800 100 14 98
Список литературы:
- Миелодиспластический синдром. Клинические рекомендации Ассоциации Онкологов России, 2019.
- Миелодиспластический синдром у взрослых. Клинические рекомендации Национального гематологического общества, 2014.
- Усс А.Л. Миелодиспластический синдром: классификация, прогноз, лечение. Проблемы здоровья и экологии. С.57-62.
- Косанова А.К. и соавт. Рефрактерные анемии и цитопении как диагностические критерии при миелодиспластических синдромах. Вестник КазНМУ, 2015, № 1. С. 131-133.
- Кохно А.В. и соавт. Миелодиспластический синдром. Клиническая геронтология. 2009. № 3. С. 33-46.
- Зельцер А.Н. Миелодиспластический синдром: трудности и успехи диагностики. Журнал фундаментальной медицины и биологии. 2017. № 1. С. 27-37.
- Myelodysplastic Syndromes. NCCN Guideline version 2.2020.
Лейкемоидные реакции: диагностика
Перед тем, как приступить к лечению, гематологи ЦЭЛТ проводят диагностику, направленную на выявление этиологического фактора, спровоцировавшего лейкемоидную реакцию. Для этого пациенту назначают:
- Анализы крови, которые, при наличии реакции выявляют повышенный показатель СОЭ и С-реактивного белка, наличие аутоантител. Проводится подсчёт лейкоцитов, определяется соотношение их форм в процентах;
- Посев крови на стерильность, исследование мокрот и урины, направленнее на точное определение возбудителя. Ферментный иммуносорбентный тест выявляет выработанные организмом антитела;
- Рентгенографическое исследования грудной клетки и суставов дают выявляют затемнения и инфильтраты в лёгких при их заболеваниях (в первом случае) и признаки артритов (во втором);
- УЗ-сканирование даёт возможность определить инфекционный мононуклеоз и другие патологии, способные привести к увеличению числа белых кровяных телец;
- Гистология костного мозга выявляет гиперпластические процессы, увеличения количества бластных клеток, а биопсия поражённого лимфоузла – аномальное разрастание коллагена и злокачественную гранулёму.
Что такое Острый миелоидный лейкоз (острый нелимфобластный лейкоз, острый миелогенный лейкоз) —
Острый миелоидный лейкоз (ОМЛ) – это онкологическое заболевание, при котором спинной мозг продуцирует аномальные миелобластные клетки (вид лейкоцитарных клеток), эритроциты или тромбоциты.
Острый миелоидный лейкоз встречается у людей всех возрастов, но главным образом — у взрослых. Вероятность развития острого миелоидного лейкоза увеличивается в случае воздействия больших доз радиации и использования некоторых средств химиотерапии по поводу злокачественной опухоли.
Острый миелоидный лейкоз относительно редко встречающаеся злокачественное заболевание. Так, в США ежегодно выявляется 10 500 свежих случаев ОМЛ, а заболеваемость сохраняется неизменной с 1995 по 2005 г. Смертность от ОМЛ составляет 1,2 % всей онкологической смертности в США.
Уровень заболеваемости ОМЛ увеличивается с возрастом, средний возраст выявления заболевания составляет 63 года. На ОМЛ приходится около 90 % всех острых лейкозов у взрослых, но у детей он встречается редко.
Заболеваемость ОМЛ, связанным с предшествующим лечением (то-есть, ОМЛ, вызванным предшествующей химиотерапией) возрастает. В настоящее время такие формы достигают 10-20 % от всех случаев ОМЛ. ОМЛ несколько чаще встречается у мужчин, заболеваемость соотносится как 1,3 к 1.
Существуют некоторые географические отличия в заболеваемости ОМЛ. У взрослых высшая заболеваемость у взрослых приходится на Северную Америку, Европу и Океанию, а в Азии и Латинской Америке заболеваемость ОМЛ ниже. И наоборот, детский ОМЛ в Северной Америке и в Индии встречается реже, чем других частях Азии. Эти различия могут определяться генетическими особенностями населения и особенностями окружающей среды.
Классификация острого миелоидного лейкоза
Всемирная организация здравоохранения предлагает классификацию этого заболевания, которая включает в себя несколько десятков разновидностей и имеет следующие группы:
- ОМЛ с типичными генетическими изменениями;
- ОМЛ с изменениями, обусловленными дисплазией;
- Вторичные острые миелоидные лейкозы, возникшие в результате лечения других заболеваний;
- Болезни с пролиферацией миелоидного ростка при синдроме Дауна;
- Миелоидная саркома;
- Бластная плазмацитоидная дендритноклеточная опухоль;
- Другие виды острого миелоидного лейкоза.
При этом у разных видом лейкоза могут разниться тактика лечения, прогноз, а также продолжительность ремиссии, что вносит дополнительные сложности.
Бесплатная консультация по вопросам обучения
Наши консультанты всегда готовы рассказать о всех деталях!
Рак крови. Симптомы.
Врачи Российско — японского онкологического центра выделяют симптомы, по которым можно диагностировать рак крови.
Первоначальные симптомы рака крови:
- Головные боли, головокружение
- Боли в костях и ломота в суставах
- Отвращение к еде и запахам
- Поднимается температура без определенных признаков и заболеваний
- Общая слабость и быстрая утомляемость.
- Частые инфекционные заболевания.
Данные симптомы рака крови могут указывать и на другие болезни, из-за чего пациент редко обращается на этой стадии к врачу онкологу, тем самым теряет много времени.
Вторичные симптомы рака крови:
- Бледность
- Желтизна кожи
- Сонливость
- Раздражительность
- Кровотечения
Также увеличиваются лимфоузлы, печень и селезенка, живот раздувается в размере, появляется сильное ощущение вздутия живота. На поздних этапах появляются высыпание на кожи, кровоточивость дёсен.
При поражении лимфатических узлов, они становятся плотными на ощупь, безболезненные. При этом нужно сразу же обратиться к врачу!!
Основные симптомы рака крови
- У больного раком крови ломит кости и суставы
- Частые кровотечения из носа
- Боли в брюшной полости
- Больному часто хочется в туалет
- Тошнота и рвота
- Частые инфекционные заболевания
- Синеватый оттенок губ и ногтей
- Человек постоянно теряет в весе
- Наблюдается высокая температура
Симптомы рака крови мало зависят от пола больного.
Разновидности заболевания накладывает свой отпечаток на то, что именно ощущает пациент при раке крови. Симптомы для различных видов лейкозов могут отличаться.
По мере прогрессирования заболевания, симптомы становятся более выраженными. Появляются боли!
Общее описание
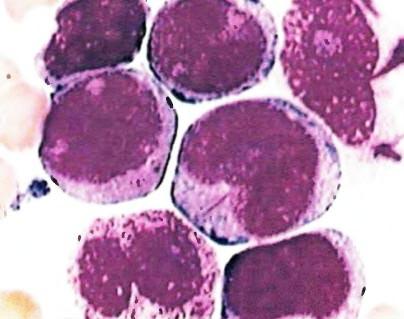 Острый миелолейкоз (ОМЛ) представляет собой злокачественное заболевание кроветворной системы, в основе которого лежит неконтролируемая продукция лейкоцитов, где источником опухолевого роста является клетка-предшественник миелоцитов. ОМЛ является быстропрогрессирующим заболеванием по сравнению с хроническим миелолейкозом, и намного раньше заканчивается летально. ОМЛ наблюдается примерно у 3 человек из 100 тысяч, в основной массе — это пожилые люди с преобладанием лиц мужского пола. Средняя продолжительность жизни с момента верификации диагноза — не более 1 года.
Острый миелолейкоз (ОМЛ) представляет собой злокачественное заболевание кроветворной системы, в основе которого лежит неконтролируемая продукция лейкоцитов, где источником опухолевого роста является клетка-предшественник миелоцитов. ОМЛ является быстропрогрессирующим заболеванием по сравнению с хроническим миелолейкозом, и намного раньше заканчивается летально. ОМЛ наблюдается примерно у 3 человек из 100 тысяч, в основной массе — это пожилые люди с преобладанием лиц мужского пола. Средняя продолжительность жизни с момента верификации диагноза — не более 1 года.
Факторами, способствующими возникновению ОМЛ являются:
- наследственная детерминация;
- воздействие ароматических углеводородов в качестве профредности;
- некоторые вирусные инфекции;
- ионизирующее излучение;
- прием цитостатических препаратов;
- синдром Дауна.
Состояние болезни на момент установления диагноза носит название первой атаки. В настоящее время различают 7 подгрупп ОМЛ, имеющих сходную клиническую симптоматику.
Что провоцирует / Причины Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
Был выявлен ряд факторов, способствующих возникновению ОМЛ — иные расстройства системы кроветворения, воздействие вредных веществ, ионизирующее излучение, и генетическое влияние.h
Пре-лейкоз
«Пре-лейкозные нарушения кроветворения, такие, как миелодиспластический синдром или миелопролиферативный синдром могут привести к ОМЛ; вероятность заболевания зависит от формы миелодиспластического или миелопролиферативного синдрома.
Воздействие химических веществ
Противоопухолевое химиотерапевтическое воздействие, особенно алкилирующими веществами, может увеличивать вероятность возникновения ОМЛ в последующем. Наивысшая вероятность заболевания приходится на 3-5 лет после химиотерапии. Другие химиотерапевтические препараты особенно эпиподофилотоксины и антрациклины, также связываются с постхимиотерапевтическими лейкозами. лейкозы такого вида часто объясняют специфическими изменениями в хромосомах лейкозных клеток.
Воздействие бензола и других ароматических органических растворителей, связанное с профессиональной деятельностью, в качестве возможной причины ОМЛ остаётся спорным. Бензол и многие его производные проявляют канцерогенные свойства . Данные некоторых наблюдений подтверждают возможность влияния профессиональных контактов с этими веществами на вероятность развития ОМЛ, однако другие исследования подтверждают, что если и существует такая опасность, то она является лишь добавочным фактором.
Ионизирующее излучение
Воздействие ионизирующего излучения повышает вероятность заболеваня ОМЛ. У переживших атомную бомбардировку Хиросимы и Нагасаки заболеваемость ОМЛ повышена, так же как у рентгенологов, получивших высокие дозы рентгеновского излучения в то время, когда меры радиологической защиты были недостаточными.
Генетические факторы
Вероятно, существует наследственно повышенная вероятность заболевания ОМЛ. Есть большое количество сообщений о множестве семейных случаев ОМЛ, когда заболеваемость превышала среднестатистическую. Вероятность возникновения ОМЛ у ближайших родственников больного втрое выше.
Ряд врождённых состояний может повышать вероятность ОМЛ. Чаще всего это синдром Дауна, при котором вероятность ОМЛ повышена в 10 — 18 раз.
3.Диагностика хронического миелолейкоза
Для диагностики хронического миелолейкоза исследуется кровь и костный мозг пациента. Для этих целей могут быть сделаны:
- Общий анализ крови (он поможет определить количество в крови разных типов клеток);
- Биохимический анализ крови – это исследование, которое позволяет измерить количество определенных веществ, выбрасываемых в кровь органами и тканями;
- Биопсия костного мозга. Во время этой процедуры берется маленький образец костного мозга, крови и кости с помощью длинной полой иглы, вставляемой в тазовую кость или грудину. Затем образцы рассматриваются под микроскопом в целях обнаружения аномальных клеток. В ходе исследований взятые образцы могут быть подвергнуты цитогенетическому анализу (для поиска хромосомных изменений), исследования генов и хромосом с помощью флуоресценции и химическому воздействию, которое тоже помогает выявить изменения в структуре и функциях генов;
- Кроме того, общий осмотр поможет врачу оценить состояние здоровья пациента в целом и увидеть увеличение селезенки – один из общих признаков хронического миелолейкоза.
ЛЕЧЕНИЕ РАКА КРОВИ.
Лечение рака крови — это комплекс мероприятий, направленных на избавление от болезни, улучшение самочувствия пациента и возвращение его к полноценной жизни.
Существуют протокольные методики лечения рака крови, такие как, химиотерапия, гормональная терапия, хирургическое лечение, лучевая терапия и другие.
Наихудший прогноз рака крови отмечается при отсутствии лечения или самолечении, почти 98% пациентов погибают в течении 2-х лет после постановки диагноза.
Пациенты обратившиеся на I стадии.
На протяжении года после обнаружения рака крови после проведенного реабилитационного лечения из 100% обратившихся выживает и живет полноценной жизнью более 20 лет — почти 98 % пациентов.
Пациенты обратившиеся на II стадии.
На протяжении года после обнаружения рака крови после проведенного реабилитационного лечения из 100% обратившихся выживает и живет полноценной жизнью более 15 лет — почти 82 % пациентов..
Пациенты обратившиеся на III стадии.
На протяжении года после обнаружения рака крови после проведенного реабилитационного лечения из 100% обратившихся выживает и живет полноценной жизнью более 10 лет — почти 65 % пациентов.
Пациенты обратившиеся на IV стадии.
На протяжении года после обнаружения рака крови после проведенного реабилитационного лечения из 100% обратившихся выживает и живет полноценной жизнью более 4 лет — почти 21 % пациентов.
Пациент должен помнить, что рак крови является довольно агрессивным видом рака. Возможны рецидивы, поэтому мы в обязательном порядке проводим наблюдение наших пациентов не реже 2-х раз в год и повторяем поддерживающий комплекс реабилитационных мероприятий через полтора — два года.
Наш опыт показывает, что лечение рака крови всегда возможно!
Разработанные и апробированные методики нашего Онкоцентра направляется на излечение от этого недуга, уменьшение его симптоматики , предупреждение прогрессирования заболевания и улучшения качества жизни!
Симптомы Острого миелоидного лейкоза (острого нелимфобластного лейкоза, острого миелогенного лейкоза):
Клиническая картина ОМЛ достаточно хорошо известна и проявляется следующими синдромами: анемическим, геморрагическим и токсическим, которые характеризуются бледностью кожных покровов, выраженной слабостью, головокружением, снижением аппетита, повышенной утомляемостью, лихорадкой без проявлений катаральных явлений.
Лимфатические узлы у большинства больных — небольших размеров, безболезненные, не спаяны с кожей и друг с другом. В редких случаях наблюдаются увеличенные лимфатические узлы размером от 2,5 до 5 см с образованием конгломератов в шейно-надключичной области. Изменения в костно-суставной системе в некоторых случаях проявляются выраженными оссалгиями в нижних конечностях и в области позвоночного столба, что сопровождается нарушением движений и походки. На рентгенограммах костной системы отмечаются деструктивные изменения различной локализации, периостальные реакции, явления остеопороза. У большинства детей наблюдается небольшое увеличение печени и селезенки (выступают из-под края реберной дуги на 2-3 см).
Экстрамедуллярные опухолевые поражения чаще проявляются гингивитом и экзофтальмом, в том числе двусторонним; в редких случаях бывают опухолевая инфильтрация мягких тканей, гипертрофия нёбных миндалин, поражение носоглотки и лицевого нерва, а также лейкемиды на коже.
Экстрамедуллярные локализации ОМЛ объединяет термин «гранулоцитарная (миелобластная) саркома», включающая классическую хлорому и непигментированные опухоли.
По данным аутопсии, гранулоцитарная (миелобластная) саркома диагностируется в 3-8% случаев у больных ОМЛ. Она может предшествовать или сочетаться с признаками ОМЛ, характеризующимися бластной инфильтрацией костного мозга и наличием бластов в периферической крови, а также наблюдаться при рецидиве заболевания. Наиболее частой локализацией опухолевого роста является орбита (поражаются орбитальная ткань и внутренние структуры черепа). Бластные клетки чаще представлены М2-типом, имеющими транслокацию t(8;21). Ряд авторов указывают на более плохой прогноз у этих больных, чем при типичном ОМЛ.
Факторы прогноза у больных ОМЛ менее изучены, чем у больных с ОЛЛ. Было проведено большое количество одно- и многофакторных исследований, с помощью которых появилась возможность определения благоприятных и неблагоприятных признаков заболевания для назначения рационального лечения. Факторы, от которых зависит прогноз ОМЛ у детей, разделяют на клинические и лабораторные. К клиническим можно отнести возраст, пол, анамнез, размеры паренхиматозных органов, выраженность геморрагического синдрома, инициальное поражение ЦНС, время наступления ремиссии, количество курсов химиотерапии. Среди лабораторных прогностических факторов выделяют чувствительность бластных клеток к химиопрепаратам in vitro, количество лейкоцитов в анализе периферической крови, FAB-вариант ОМЛ, уровень фибриногена, уровень лактатдегидрогеназы, наличие палочек Ауэра в бластах.
Прогноз при ОМЛ зависит от FAB-морфологического варианта, данных генетического исследования и иммунофенотипа бластных клеток. Так, наиболее благоприятную группу составляют больные с морфологическими вариантами М1, М2 и t(8;21), t(9;11), М3 и t(15;17) или М4 и inv(16). В неблагоприятную для прогноза группу входят больные с вариантами М4 без inv(16), М5, М6 и М7, а также пациенты, при исследовании кариотипа опухолевых клеток которых были выявлены следующие хромосомные аномалии: t(9;22), t(6;11), t(10;11), del5q-, del7q-, моносомии -5, -7. Кроме того, нашими исследованиями удалось доказать, что на прогноз ОМЛ неблагоприятно влияет экспрессия эритроитных и В-линейных антигенов на поверхности бластов.