Синовиальная саркома суставов: характеристика, клиника, диагностика и лечение
Содержание:
- Характеристика заболевания
- Саркомы мягких тканей лечение 1, 2, 3 стадии. Симптомы, признаки, метастазы, прогноз.
- 1. Общие сведения о происхождении сарком мягких тканей
- 2. Какие бывают формы сарком мягких тканей
- 3. Некоторые эпидемиологические аспекты (статистика) сарком мягких тканей
- 4. Группы риска и факторы, предрасполагающие к развитию сарком мягких тканей
- 5. Клинические проявления сарком мягких тканей
- 6. Как выявляются саркомы мягких тканей
- Профилактика и раннее выявление сарком мягких тканей
- Что такое остеосаркома?
- ПОДТИПЫ ОСТЕОСАРКОМ
- Что такое Остеогенная саркома —
- Этиология и патологическая анатомия
- Уход
- Диагностика
- Что важно для прогноза течения саркомы мягких тканей?
- Лечение саркомы мягких тканей
- Причины
Характеристика заболевания
Саркома кости – это редкий вид злокачественного онкологического заболевания, который развивается в области мягких тканей и в полости кости. Главное отличие заключается в автономном развитии, нет привязки к конкретному органу. Поражает костный участок тела, но есть примеры развития в ткани, не имеющей костной принадлежности. Скелет может пострадать в любом участке.
Опухоль предпочитает локализоваться в зоне длинных трубчатых костей и места соединения. Рак развивается быстро, разрушая кость и проникая в костный канал с мышцей. Агрессивный характер патологии характеризуется ранним метастазированием в ткани головного мозга и лёгких с формированием вторичных очагов.
Раньше болезнь считалась неизлечимой – выживало только 10% пациентов. В последние годы с внедрением в медицинскую практику новейшего оборудования и новых методик лечения шансы у больных увеличились.
Согласно медицинской статистике мужчины страдают саркомой чаще, чем женщины – примерно в 2 раза. Пик приходится на подростковый период. У взрослых людей после 50 лет встречается редко. В зоне риска находятся люди с высоким ростом.
Опухоль чаще развивается на ноге – в пяточной, бедренной и тазобедренной зоне. На руках встречается редко, поражается плечевой сустав.
 Саркома в костях
Саркома в костях
Саркомы мягких тканей лечение 1, 2, 3 стадии. Симптомы, признаки, метастазы, прогноз.
1. Общие сведения о происхождении сарком мягких тканей
Мягкими тканями обозначаются все неэпителиальные внескелетные ткани (мышцы, сухожилия, связки и др.), за исключением ретикулоэндотелиальной системы, глии и тканей, поддерживающих специфические органы и внутренности.
В связи с относительно небольшим числом случаев заболевания, разнообразием вариантов и локализаций сарком мягких тканей, определяющих биологическое поведение, клиническое течение и особенности лечения, все пациенты с данной патологией должны концентрироваться в профильных отделениях, занимающихся лечением сарком.
2. Какие бывают формы сарком мягких тканей
Саркомы мягких тканей – собирательное понятие и включают обширную группу злокачественных новообразований, различающихся по своему клиническому течению, прогнозу и методам лечения.
Наиболее часто встречаются:
- липосаркома (из жировой клетчатки);
- лейомиосаркома и рабдомиосаркома (из мышечной ткани);
- синовиальная саркома (из синовиальных оболочек суставов);
- фибросаркома (из фиброзной ткани);
- ангиосаркома (из кровеносных сосудов) и др.
3. Некоторые эпидемиологические аспекты (статистика) сарком мягких тканей
Злокачественные опухоли мягких тканей в структуре онкологической заболеваемости составляют примерно 1 % от всех злокачественных новообразований.
Средний возраст заболевших составляет около 50 лет.
Большинство злокачественных опухолей мягких тканей являются саркомами.
Наиболее часто саркомы развиваются на нижних конечностях (до 40 % случаев).
4. Группы риска и факторы, предрасполагающие к развитию сарком мягких тканей
Большинство сарком возникает спонтанно (без видимых причин). К факторам риска развития заболевания относятся: химические канцерогены (диоксин, гербициды и хлорфенолы и др.), отягощенная наследственность (нейрофиброматоз 1-го типа, синдром Ли-Фраумени, синдром Гарднера и др.).
Саркомы могут развиваться в мягких тканях ранее подверженных облучению. Саркомы могут развиваться у лиц, которым проводится иммуносупрессивная терапия после трансплантации органов (саркома Капоши), а также у взрослых после проведенной в детском возрасте химиотерапии. Относительно редко саркома может развиваться на фоне длительно существующего выраженного хронического лимфатического отека конечности (лимфангиосаркома).
5. Клинические проявления сарком мягких тканей
Обычно саркома характеризуется появлением беспричинной, как правило, безболезненной медленно растущей опухоли (пальпируемого образования на конечностях и др. частях тела).
Общее состояние может оставаться удовлетворительным даже при наличии саркомы больших размеров, поэтому при наличии любой длительно существующей небольшой припухлости, особенно глубоко расположенной, необходимо срочно обратиться к онкологу для уточнения диагноза. Течение саркомы мягких тканей зависит главным образом от ее степени злокачественности.
Саркомы принято делить на высокозлокачественные (низкодифференцированные) и низкозлокачественные (высокодифференцированные).
Высокозлокачественные саркомы характеризуются выраженной склонностью к развитию отдаленных метастазов (печень, легкие и др.) и относительно редким метастазированием в регионарные лимфатические узлы.
Низкозлокачественные саркомы метастазируют реже, но они склонны к упорному местному развитию рецидивов.
6. Как выявляются саркомы мягких тканей
Диагностика саркомы проводится путем осмотра онкологом, применения средств современной медицинской визуализации (ультразвуковое исследование, рентгеновская компьютерная и/или магниторезонансная томография) с последующей биопсией опухоли (трепано — или открытая биопсия). Необходимость других дополнительных методов обследования определяется индивидуально.
Профилактика и раннее выявление сарком мягких тканей
Специфической профилактики сарком мягких тканей нет. С целью раннего выявления сарком, пациенты, входящие в группу риска (нейрофиброматоз 1-го типа, синдром Ли-Фраумени, синдром Гарднера, иммуносупрессивная терапия после трансплантации органов, лимфедема конечности) должны проходить ежегодные контрольные осмотры.
Что такое остеосаркома?
Кости содержат несколько типов клеток. Остеобласты ответственны за образование основы костей, а именно, соединительной ткани и неорганических веществ (минералов), которые обеспечивают прочность костей.
Остеокласты помогают регулировать уровень неорганических веществ в крови, влияя на отложение и удаление этих веществ из костей, что дает возможность костям сохранять необходимую форму. Костный мозг, имеющийся в некоторых костях, содержит жировые, а самое главное, гематопоэтические клетки, производящие различные клетки крови.
Различают плоские и длинные трубчатые кости. Плоские кости помогают защищать от повреждений головной мозг и органы грудной полости, живота и таза. Например, кости черепа и грудина относятся к плоским костям, а кости верхних и нижних конечностей — к длинным трубчатым костям.
Остеосаркома является наиболее часто встречающейся опухолью костей.
Как и другие злокачественные опухоли, остеосаркома может распространяться на близлежащие ткани (мышцы, сухожилия, жировую ткань), а также через кровоток в другие кости, легкие и другие внутренние органы. Это процесс носит название метастазирование.
Чаще всего остеосаркома возникает на концевых частях длинных трубчатых костей, особенно в области коленных суставов. 80% остеосарком у детей и подростков развивается именно в этих областях. Второй по частоте локализацией остеосарком является верхний отдел плечевой кости. Однако остеосаркома может возникнуть в любой кости, включая кости таза и челюсть.
Не все злокачественные опухоли костей являются остеосаркомами. Саркома Юинга является второй по частоте злокачественной опухолью у детей и подростков. Другие опухоли обычно выявляются у взрослых и очень редко у детей. К ним относятся хондросаркома, возникающая из хряща, и злокачественная фиброзная гистиоцитома.
К доброкачественным опухолям костей относятся остеомы, хондромы, остеохондромы, эозинофильные гранулемы, фибромы, ксантомы, гигантоклеточные опухоли и лимфангиомы.
ПОДТИПЫ ОСТЕОСАРКОМ
Различают несколько подтипов остеосарком с различным прогнозом заболевания.
Выделяют остеосаркомы низкой, промежуточной и высокой степенью злокачественности.
Среди остеосарком высокой степени злокачественности обнаруживают остеобластические, хондробластические, фибробластические, смешанные, мелкоклеточные и телангиэктатические варианты.
Периостальный вариант относится к остеосаркомам промежуточной степени злокачественности, в параостальный и интрамедуллярный варианты — к остеосаркомам низкой степени злокачественности.
Степень злокачественности остеосарком определяет прогноз заболевания.
Так, после полного удаления остеосаркомы низкой степени злокачественности обычно не требуется химиотерапия и исход заболевания благоприятный.
При остеосаркомах высокой степени злокачественности необходимо применение как оперативного вмешательства, так и химиотерапии. Исход заболевания у больных с остеосаркомами промежуточной степени злокачественности непостоянен.
Большинство остеосарком у детей относится к опухолям высокой степени злокачественности.
Что такое Остеогенная саркома —
Остеогенная саркома — саркома, злокачественные клетки которой происходят из костной ткани и продуцируют эту ткань. В некоторых из этих опухолей доминируют хондробластические или фибробластические компоненты. Рентгенологически подразделяется на остеолитическую, остеопластическую (склеротическую) и смешанную формы.
Остеогенная саркома — чрезвычайно злокачественное новообразование. Возникая непосредственно из элементов кости, она характеризуется бурным течением и склонностью рано давать метастазы.
Остеогенная саркома наблюдается в любом возрасте, но около 65 % всех случаев падает на период от 10 до 30 лет, и чаще всего развитие саркомы отмечается в конце полового созревания. Мужчины поражаются в два раза чаще, чем женщины. Излюбленной локализацией являются длинные трубчатые кости; на долю плоских и коротких костей падает не больше одной пятой части всех остеогенных сарком. Кости нижних конечностей в 5-6 раз чаще поражаются, чем кости верхних конечностей, и 80 % всех опухолей нижних конечностей гнездятся в области коленного сустава. Первое место по частоте занимает бедро, на долю которого падает половина всех остеогенных сарком, затем следует большеберцовая кость, плечевая, тазовые кости, малоберцовая, плечевой пояс, локтевая кость. Лучевая кость, где так часто наблюдается гигантоклеточная опухоль, исключительно редко дает рост остеогенной саркомы. Почти никогда остеогенная саркома не исходит из надколенника. Поражение черепа имеет место главным образом в детском возрасте, а также в старости в качестве осложнения обезображивающей остеодистрофии. Типичной локализацией остеогенной саркомы в длинных трубчатых костях является мета- эпифизарный конец, а у детей и юношей, до наступления синостоза, — метафиз кости. В бедренной кости поражается обыкновенно дистальный конец, но около 10 % остеогенных сарком бедра гнездятся в диафизе и оставляют метафизы нетронутыми. В большеберцовой кости остеогенная саркома только в одном случае из десяти располагается в дистальном конце — типичным местом служит проксимальный медиальный мыщелок. Таким же типичным местом для плечевой кости является область шероховатости дельтовидной мышцы.
Этиология и патологическая анатомия
Этиологические факторы синовиальной саркомы, как почти всех онкологических заболеваний, до конца не ясны. В качестве предполагаемых причин возникновения подобного рода сарком описываются предраковые состояния (шваннома, дисплазия прилежащих к опухоли тканей), постоянная сильная травматизация суставов, наличие инородных тел.
При микроскопическом исследовании биоптата типичной находкой будут веретенообразные клетки с железистоподобными структурами. По своим морфологическим характеристикам злокачественная синовиома чрезвычайно разнообразна: под микроскопом между малодифференцированными клетками округлой формы (или напоминающих эпителий) можно увидеть щели или полости, которые заполнены слизеподобными структурами. При преобладании сосочковых элементов наподобие синовиальных ворсинок, опухоль относят к волокнистой форме. Новообразование может иметь много железистых клеток, и тогда его называют целлюлярной синовиальной саркомой. Если же рассматривать данные ВОЗ, то её эксперты разделяют данную опухоль на монофазный веретенообразный и бифазный гистологические субтипы
Определение точного морфологического варианта новообразования имеет важное значение для дальнейшего прогноза
Уход
Полная радикальная хирургическая резекция рака единым блоком является методом выбора при остеосаркоме. Хотя около 90% пациентов могут перенести операцию по спасению конечностей , осложнения, особенно инфекция, расшатывание протеза и несращение или местный рецидив опухоли, могут вызвать необходимость в дальнейшей операции или ампутации.
Мифамуртид используется после операции по удалению опухоли и вместе с химиотерапией для уничтожения оставшихся раковых клеток, чтобы снизить риск рецидива рака. Также существует возможность ротационной пластики после удаления опухоли.
Пациентов с остеосаркомой лучше всего лечить у онколога-онколога и онколога-ортопеда, имеющего опыт лечения сарком. В настоящее время стандартным лечением является неоадъювантная химиотерапия (химиотерапия перед операцией) с последующей хирургической резекцией. Процент некроза опухолевых клеток (гибель клеток), наблюдаемый в опухоли после операции, дает представление о прогнозе, а также позволяет онкологу узнать, следует ли изменить режим химиотерапии после операции.
Стандартная терапия представляет собой комбинацию ортопедической хирургии по спасению конечностей, когда это возможно (или ампутации в некоторых случаях), и комбинацию высоких доз метотрексата с спасением лейковорина , внутриартериального цисплатина , адриамицина , ифосфамида с месной , BCD ( блеомицин , циклофосфамид , дактиномицин). ), этопозид и мурамилтрипептид. Может использоваться ротационная пластика . Ифосфамид можно использовать в качестве адъювантного лечения, если скорость некроза низкая.
Несмотря на успех химиотерапии остеосаркомы, у нее один из самых низких показателей выживаемости при онкологических заболеваниях у детей. Лучшая зарегистрированная 10-летняя выживаемость составляет 92%; Используемый протокол представляет собой агрессивный внутриартериальный режим, который индивидуализирует терапию на основе артериографического ответа. Трехлетняя выживаемость без событий колеблется от 50% до 75%, а пятилетняя выживаемость колеблется от 60% до 85 +% в некоторых исследованиях. В целом 65–70% пациентов, пролеченных пять лет назад, будут живы сегодня. Эти показатели выживаемости являются средними и сильно различаются в зависимости от индивидуальной скорости некроза.
Филгращу или Pegfilgrastim помощи с клеточными белыми кровяными подсчетами и нейтрофильными пунктами. При анемии помогают переливание крови и эпоэтин альфа . Вычислительный анализ на панели клеточных линий остеосаркомы выявил новые общие и специфические терапевтические мишени (протеомные и генетические) при остеосаркоме, в то время как фенотипы показали повышенную роль микроокружения опухоли.
Диагностика
В LISOD при болезни рак костей диагностика, кроме осмотра, сбора анамнеза и стандартных исследований крови, предполагает:
- клиническое обследование;
- использование методов медицинской визуализации:
— компьютерная томография; — ультразвуковое исследование; — рентгенографический метод;
- морфологическую диагностику с установлением типа опухоли;
- иммуногистохимические и методы молекулярной биологии (исследования проводятся в референтных лабораториях Израиля и Германии).
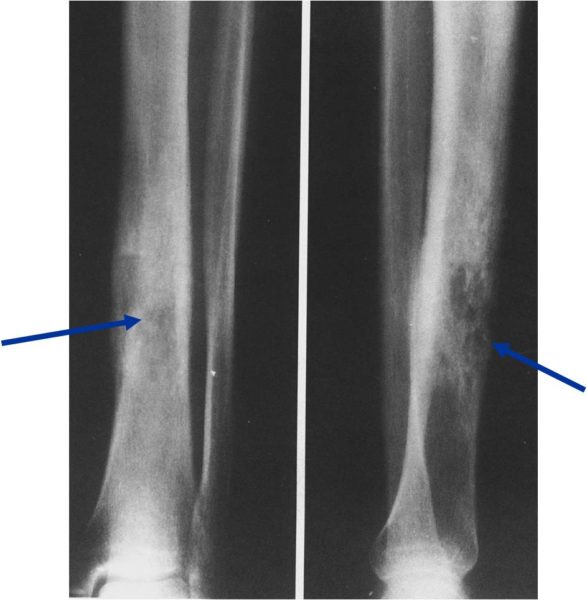
Рентгенологическое обследование является первым и важным диагностическим тестом. Саркомы имеют характерную картину на рентгенограмме. При этом видны либо темные пятна в пораженных участках кости, либо светлые пятна в тех местах, где в результате опухоли образуются отложения кальция с формированием новых костей (склероз). Более чувствительный метод – это компьютерная томография. Он позволяет выявить очень мелкие «горячие точки», не видимые на рентгенограмме. При заболевании рак позвоночника диагностика обязательно включает компьютерную томографию. При раке кости диагностика также проводится еще более информативным методом — ПЭТ-КТ. Исследование назначают в ряде случаев:
- для определения стадии высокодифференцированных сарком с недоказанной метастатической болезнью (саркома Юинга, рабдомиосаркома, лейомиосаркома, остеосаркома, злокачественная фиброзная гистиоцитома, синовиальная саркома и миксоидная липосаркома);
- для оценки ответа на лечение высокодифференцированных сарком;
- для диагностики пациентов, которым предстоит удаление метастазов в печени или легких (с целью исключения экстараторакального и экстарпеченочного поражения).
Биопсия (1) необходима для постановки окончательного диагноза, когда имеется подозрение на саркому, а первичные опухоли в других органах не обнаружены. При вторичной опухоли костей, когда известно место образования первичной опухоли, биопсия, как правило, не требуется. Обычно делают пункционную биопсию под местной анестезией. Все дальнейшие обследования проводятся для того, чтобы определить распространение опухолевых клеток (в случае вторичной опухоли) или обнаружить первичное поражение. Такие исследования включают, как правило, КТ-сканирование грудной клетки (куда чаще всего метастазируют первичные опухолевые поражения других органов), ультразвуковое обследование печени.
Что важно для прогноза течения саркомы мягких тканей?
Стадия заболевания определяется размером опухолевого узла и предусмотрено только два варианта — менее или более 5 см
Важно расположение опухоли относительно поверхностной фасции — соединительнотканной оболочки на мышечном массиве, как показателя интенсивности внедрения в окружающие структуры, тоже два варианта: над и под фасцией
Для подбора оптимальной терапии необходимо знать степень злокачественности, которую выводят по сумме баллов, присуждаемых за определённый гистологический признак. Рассматриваются выявляемые при микроскопии кусочка саркомной ткани такие гистологические критерии:
- дифференцировка — степень отличия от нормальной мезенхимальной (соединительной) ткани; всего 3 степени, которым присуждается от 1 до 3 баллов;
- митозы — процесс деления клетки; их число градуируется тоже по 3 позициям, минимально число до 9 и максимально — больше 19 митозов;
- некроз — мёртвые клетки в массиве опухолевой ткани, до 50% и более.
Высокая степень агрессивности G3 отмечается при 6-8 баллах, низкая G1 — сумма до 3 баллов и в их интервале средняя G2.
Лечение саркомы мягких тканей
Выбор метода лечения саркомы определяется степенью ее злокачественности, местом расположения и наличием метастазов. Для лечения низкозлокачественных опухолей, лечение преимущественно хирургическое, в остальных случаях используются комбинированные методы, включающие облучение и химиотерапию.
Хирургическое лечение
При хирургическом лечении сарком используются следующие виды операций:
- Широкая местная резекция. Таким способом удаляются низкозлокачественные небольшие новообразования, располагающиеся в коже и подкожной клетчатке.
- Широкое иссечение. При таком вмешательстве саркома удаляется в пределах анатомической зоны, отступая от края новообразования не менее чем на 4-6 см.
- Радикальная органосохраняющая операция. При таком объеме вмешательства удаляется опухоль совместно с мышечными фасциями и неизмененными мышцами, которые отсекаются в месте их прикрепления. При вовлечении в процесс кровеносных сосудов, нервных стволов и костей, производят их резекцию с одномоментной пластикой кожным или кожно-мышечным лоскутом.
- Ампутации или экзартикуляции — удаление конечности или ее вычленение по линии суставной щели. Такие вмешательства проводятся при обширных местно-распространенных высокозлокачественных процессах с вовлечением магистральных кровеносных и нервных стволов на большом протяжении, а также костных структур и мышц.
Во время операции обязательно проводится интраоперационное срочное гистологическое исследование. При наличии злокачественных клеток в краях отсечения и при потенциальной возможности радикального удаления опухоли, выполняют реоперацию.
Лучевая терапия
Лучевая терапия применяется в рамках комбинированного лечения в предоперационном и/или послеоперационном этапе. В первом случае преследуется цель — уменьшение размера саркомы и создание условий для проведения радикального вмешательства. Во втором — уничтожение оставшихся злокачественных клеток. Чтобы воздействие на опухоль было равномерным, используются многопольные методики облучения.
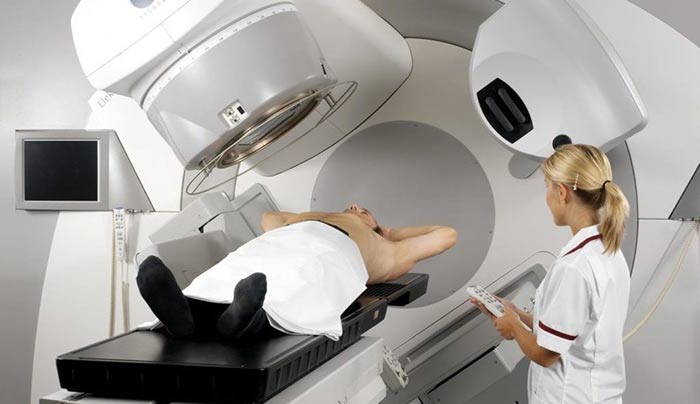
Предоперационная лучевая терапия
При предоперационной ЛТ, границы полей облучения (ПО) должны выходить за размеры ткани опухоли минимум на 3-4 см. Если опухоль имеет большие размеры, производят облучение в пределах 10 см от ее края до достижения суммарной очаговой дозы 45-50Гр. Затем ПО сокращают до размеров новообразования.
Если опухоль располагается на конечности, есть вероятность развития остеолучевого некроза, мышечных контрактур и отеков. Чтобы этого избежать, рекомендуется облучать не более 2/3 окружности конечности, если это возможно. Минимальная толщина необлучаемых тканей в зоне предплечья составляет 2 см, на бедре 4 см, и на голени — 3 см.
Послеоперационная лучевая терапия
Послеоперационная лучевая терапия показана в следующих случаях:
- Высокая степень злокачественности саркомы по данным гистологического исследования.
- Нерадикально проведенная операция — наличие злокачественных клеток в краях отсечения при невозможности проведения реоперации.
- Вскрытие капсулы саркомы во время хирургического вмешательства.
Послеоперационную ЛТ начинают выполнять не позднее, чем через 4 недели после окончания хирургического лечения.
Если предоперацинная ЛТ не выполнялась, поля облучения включают в себя следующие области:
- Ложе опухоли.
- Ткани, которые располагаются на расстоянии 2 см от удаленной опухоли.
- Послеоперационный рубец.
Облучение проводят в суммарной очаговой дозе 60 Гр. Если была проведена нерадикальная операция, дозу увеличивают до 70 Гр. В аналогичном режиме проводят лучевую терапию при невозможности оперативного лечения.

Химиотерапия
Химиотерапия широко используется для лечения высокозлокачественных сарком мягких тканей. Как и при лучевой терапии, ее могут назначать на дооперационном и/или послеоперационном этапе. Неоадъювантная (предоперационная) ХТ призвана воздействовать на очаг опухоли, уничтожать микрометастазы и создать условия для органосохраняющего хирургического лечения. С этой целью проводят 2-3 курса химиотерапии с перерывом в 3-4 недели.
Послеоперационная ХТ может проводиться для уничтожения микрометастазов или уже визуализируемых метастазов. С этой целью выполняют 3-4 курса лечения. При химиотерапевтическом лечении сарком применяют различные комбинации следующих препаратов:
- Доксорубицин.
- Этопозид.
- Винкристин.
- Ифосфамид.
- Дакарбазин.
- Цисплатин и др.
Схема химиотерапии будет определяться морфологическим вариантом опухоли и ее чувствительностью к ранее проводимому лечению.
Причины
Несколько исследовательских групп изучают раковые стволовые клетки и их способность вызывать опухоли, а также гены и белки, являющиеся причиной различных фенотипов. Лучевая терапия при несвязанных состояниях может быть редкой причиной.
- Семейные случаи, когда делеция хромосомы 13q14 инактивирует ген ретинобластомы, связаны с высоким риском развития остеосаркомы.
- Дисплазии костей, включая болезнь Педжета , фиброзную дисплазию , энхондроматоз и наследственные множественные экзостозы , увеличивают риск остеосаркомы.
- Синдром Ли – Фраумени ( мутация TP53 зародышевой линии ) является предрасполагающим фактором для развития остеосаркомы.
- Синдром Ротмунда-Томсона (т.е. аутосомно-рецессивная ассоциация врожденных дефектов костей, дисплазий волос и кожи, гипогонадизма и катаракты) связан с повышенным риском этого заболевания.
- Большие дозы Sr-90 , прозванного « искателем костей» , увеличивают риск рака костей и лейкемии у животных и, как предполагается, делают это у людей.
Нет четкой связи между фторированием воды и раком или смертностью от рака, как от рака в целом, так и конкретно от рака костей и остеосаркомы. Серия исследований пришла к выводу, что концентрация фторида в воде не связана с остеосаркомой. Убеждения относительно связи воздействия фторида и остеосаркомы проистекают из исследования Национальной токсикологической программы США в 1990 году, которое показало неопределенные доказательства связи фторида и остеосаркомы у самцов крыс. Но до сих пор нет убедительных доказательств того, что фтор у мышей вызывает рак. Фторирование воды практикуется во всем мире для улучшения здоровья зубов граждан. Это также считается большим успехом в области здравоохранения. Уровни концентрации фтора в системах водоснабжения регулируются, например, Агентство по охране окружающей среды США регулирует уровень фторида не более 4 миллиграммов на литр. На самом деле, в источниках воды уже есть фторид природного происхождения, но многие сообщества решили добавить больше фторида до такой степени, чтобы он мог уменьшить кариес. Фторид также известен своей способностью вызывать образование новой кости. Тем не менее, дальнейшие исследования не показывают риска остеосаркомы из-за фторированной воды у людей. Большая часть исследований включала подсчет числа пациентов с остеосаркомой в определенных областях, где концентрация фтора в питьевой воде различна. Статистический анализ данных не показывает существенной разницы в частоте случаев остеосаркомы в разных фторированных регионах
Другое важное исследование включало сбор образцов костей у пациентов с остеосаркомой для измерения концентрации фтора и их сравнения с образцами костей недавно диагностированных злокачественных опухолей костей. В результате средние концентрации фторида в образцах костей пациентов с остеосаркомой и контрольных опухолей существенно не различаются
Доказано, что не только концентрация фтора в костях, но и воздействие фторида на пациентов с остеосаркомой существенно не отличается от показателей здоровых людей.